产品描述
NK细胞高效扩增试剂盒是一种专门设计用于体外扩增人类自然杀伤细胞Natural Killer cells, NK cells)的生物产品。该试剂盒能够与多种免疫细胞培养基兼容,以支持从不同来源(如外周血和脐带血)分离的NK细胞的高效增殖。在11至13天的培养周期内,NK细胞的数量可以显著增加,扩增倍数可达6000至10000倍,假设原始的外周血单个核细胞(Peripheral Blood Mononuclear Cells, PBMCs)中含有10%的NK细胞。此外,该试剂盒还能保证扩增后的NK细胞具有高纯度,表现为CD3-和CD56+的表达率超过90%。
适用范围
该试剂盒适用于新鲜外周血、新鲜脐血、冻存外周血、冻存脐血来源的单个核细胞。
规格
本试剂盒规格为2L
运输和存储条件
液氮储存,干冰运输,保质期为参考下表。有效期为 6 个月,建议尽快使用。
配套产品信息
表1.试剂盒组成信息
产品货号 | 产品名称 | 产品规格 | 储存条件 |
IMC-019-BM | NK细胞基础培养基 | 1L*2 | 4℃,12个月 |
IMC-019-A | NK添加剂A | 1 mL | 液氮, 6个月 |
IMC-019-B | NK添加剂B | 4 mL | 液氮, 6个月 |
所需试剂与材料
表2. 推荐试剂&材料
试剂&材料 | 品牌(e.g.) | 货号(e.g.) |
Human IL-2 | 逸漠生物 | IMF-I02 |
庆大霉素 | 润弘制药 | — |
T75细胞培养瓶 | Corning | 430641 |
T175培养瓶 | Corning | 431080 |
淋巴细胞培养袋 | Takara | FU0002 |
Ficoll | Cytiva | 17544202 |
NK细胞高效扩增试剂盒 | 逸漠生物 | IMC-019 |
实验步骤
1.打开层流,打开生物安全柜的紫外线灯,废液缸和移液管同时照射。
2.将外周血、生理盐水和淋巴细胞分离液室温平衡至20℃。
3.NK细胞无血清培养液配制:NK细胞基础培养基(2L) + 自体血浆(后加) + IL-2(200IU/mL)+ 庆大霉素(80U/mL)
单个核细胞的分离
1.将外周血与生理盐水1:1,吹打混匀。
2.Ficoll使用前应上下颠倒混匀,按稀释后的血液与Ficoll的比例为4:3,将稀释后的血液轻缓的加在Ficoll上面。
3.400g,30min离心(升3降3),18-20℃。
4.将上层的血浆吸取到离心管中,56℃,30分钟灭活补体。之后,将血浆置于-20℃,静置15分钟,离心(800g,10min)以去除血小板,上清置于4℃备用。
5.轻轻吸取单个核细胞(白膜层)并转移至新的50mL离心管内;加入等体积生理盐水,室温700g离心10min。弃上清,再次用40mL生理盐水清洗细胞,200g离心10min,弃上清,取少量细胞悬液计数。
NK培养
1.起始培养:单个核细胞+ NK细胞基础培养基(30 mL)+ 自体血浆(1.5mL)+ NK添加剂A(37℃水浴复苏至完全溶解,复苏时间不宜过长,复苏后PBS清洗一次,350g,离心3-5min,培养液重悬加入培养瓶),在75cm2培养瓶中混合,置于37℃,5%CO2培养箱中培养。
2. 第3天离心换液:350g,离心5min,弃上清;细胞沉淀 + NK细胞基础培养基(30 mL)+ 自体血浆(1.5mL),不换瓶。
3. 第4-6每天观察细胞,根据细胞悬液颜色或显微镜下细胞状态添加培养液,一般情况下,培养液颜色发生变化或细胞较多时添加,培养液添加量参考(NK培养 7.)所述内容。每次加液时应按照加液量的5%加入自体血浆。
4. 第7天计数,加液使NK细胞浓度在(0.8-1.0)×106 Cell/mL,自体血浆按加液量的1%添加。添加NK添加剂B(37℃水浴复苏至完全溶解,复苏时间不宜过长,复苏后PBS清洗一次,350g,离心3-5min,培养液重悬加入培养瓶);当培养液体积大于250mL则转移至培养袋培养。
5. 第8-11天每天观察或计数,根据培养液颜色变化或细胞浓度添加培养液,自体血浆按加液量的1%添加,建议通过细胞计数添加培养液。推荐细胞浓度8-9天应控制在(1.0-1.5)×106Cell/mL,第10-11天应控制在(1.5-2.0)×106Cell/mL。
6. 当细胞生长至所需数量时即可进行收集使用或冻存。一般情况下, 12-13天收集细胞最佳。
7. 无血清培养过程数据参考:
时间 | Day0 | Day1 | Day2 | Day3 | Day4 | Day5 | Day6 | Day7 | Day8 | Day9 | Day10 | Day11 | Day12 | Day13 |
处理 过程 | 起始 | 不处理 | 不处理 | 换液 | 加液 | 加液 | 加液 | 加液+A2 | 加液 | 加液 | 加液 | 加液或 不处理 | 收集或 不处理 | 收集 |
细胞 状态 | / | / | / | / | 培养液颜色明显变化或细胞较多 | 细胞浓度在 0.8-1.0× 106Cell/mL | 细胞浓度在1.0-1.5×106Cell/mL | 细胞浓度在1.5-2.0×106 Cell/mL | / | / | ||||
总体积(mL) | 30 | / | / | 30 | 50 | 100- 120 | 200- 250 | 400-500 | 800- 900 | 1200- 1400 | 1600- 2000 | 2000 | / | / |
注意事项
(1)血液采集建议使用肝素钠抗凝管或枸橼酸钠采血袋。
(2)自体血浆会影响细胞的培养状态,建议自体血浆预留量为30mL左右。溶血、高脂肪可能会影响NK细胞的扩增。
(3)NK添加剂A、B的使用,应严格按照常规细胞冷冻和复苏的要求进行操作。细胞复苏过程中严禁直接将冻存管全部浸没在水浴内,建议至少应保证管盖在水浴液面以上。
(4)细胞培养过程中,培养前7天出现细胞成团属于正常现象,操作过程请注意不要破坏细胞团。
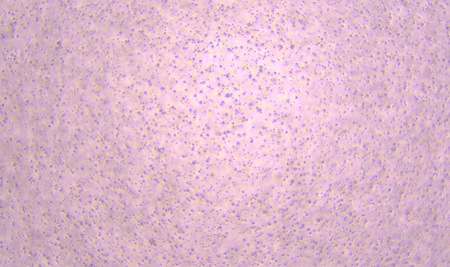
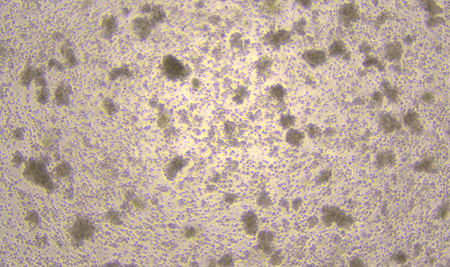
D0 D3
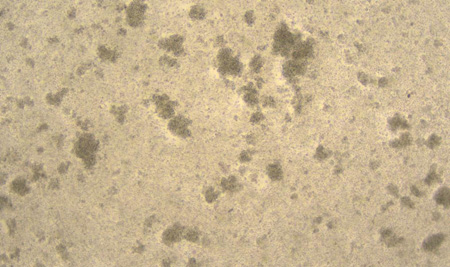
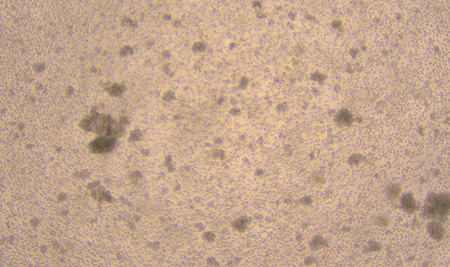
D6 D8
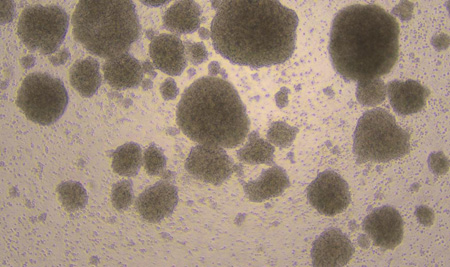
D11
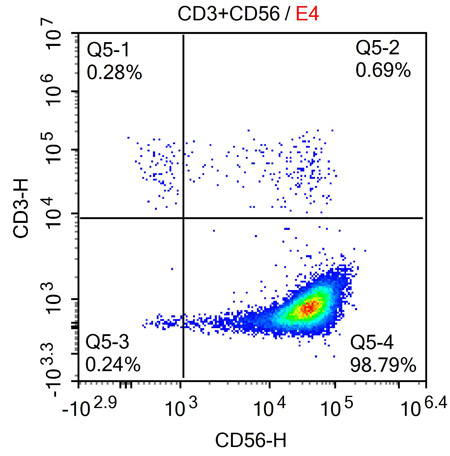
图1:NK细胞扩增D0、D3、D6、D8、D11细胞形态图示
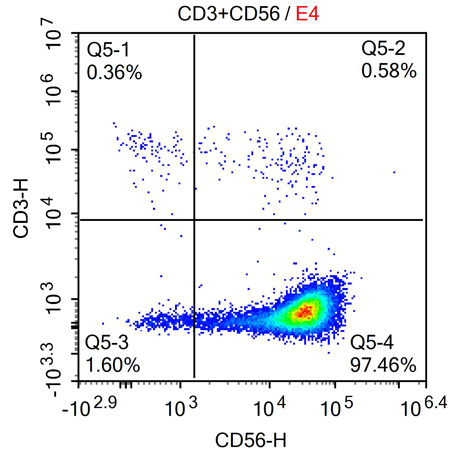
图2:培养后NK细胞的纯度检测