简介
神经干细胞( NSC ) 是具有自我更新能力的多能细胞,在胚胎发育过程中,它们首先产生放射状胶质祖细胞,这些祖细胞会生成所有动物神经系统的神经元和神经胶质细胞。一些神经祖干细胞会持续存在于成年脊椎动物大脑中高度受限的区域中,并在整个生命过程中持续产生神经元。中枢神经系统大小的差异是物种之间最重要的区别之一,因此,调节神经干细胞区室大小的基因突变是脊椎动物进化的最重要驱动因素之一。
干细胞的特点是能够分化成多种细胞类型。它们会对称或不对称地分裂成两个子细胞。在对称细胞分裂中,两个子细胞也是干细胞。在非对称分裂中,干细胞会产生一个干细胞和一个特化细胞。NSC 主要分化成神经元、星形胶质细胞和少突胶质细胞。
大脑位置
据报道,在成年哺乳动物的大脑中,海马齿状回的颗粒下区、侧脑室周围的脑室下区和下丘脑(确切地说是背部 α1、α2 区域和位于相邻正中隆起的“下丘脑增生区”)含有神经干细胞。
发展
体内起源
干细胞有两种基本类型:成体干细胞(其分化能力有限)和胚胎干细胞(ESC),后者具有多能性,能够分化成任何细胞类型。
神经干细胞比 ESC 更为专业化,因为它们只生成放射状胶质细胞,而这些细胞又会生成中枢神经系统(CNS)的神经元和胶质细胞。在脊椎动物的胚胎发育过程中,神经干细胞转变为放射状胶质细胞(RGC),也称为放射状胶质祖细胞 (RGP),并驻留在称为脑室区(VZ) 的瞬时区域中。在胚胎发育的特定时期,通过神经发生过程,神经干细胞 (RGP) 会大量生成神经元,并在成年期继续在成人大脑的某些特定区域中生成神经元。成人神经干细胞在成人脑室下区(SVZ) 内分化成新的神经元,SVZ 是胚胎生殖神经上皮的残余,也是海马齿状回的一部分。
体外起源
20 世纪 90 年代初,人们首次从小鼠纹状体中分离出成年 NSC 。它们在体外培养时能够形成多能神经球。神经球可以产生自我更新和增殖的特化细胞。这些神经球可以分化形成特定的神经元、神经胶质细胞和少突胶质细胞。在之前的研究中,培养的神经球已被移植到免疫缺陷新生小鼠的大脑中,并显示出植入、增殖和神经分化。
NSC 在微环境或干细胞微环境的外源性刺激下开始分化。一些神经细胞在受到刺激时,沿着包含骨髓样结构的脊迁移流从 SVZ 迁移,该迁移流包含室管膜细胞和星形胶质细胞。室管膜细胞和星形胶质细胞形成神经胶质管,供迁移的神经母细胞使用。管中的星形胶质细胞为迁移细胞提供支持,并隔离周围细胞释放的电信号和化学信号。星形胶质细胞是快速细胞扩增的主要前体。神经母细胞形成紧密的链并向细胞损伤的特定位置迁移以修复或替换神经细胞。一个例子是神经母细胞向嗅球迁移以分化为具有径向迁移模式而非切向迁移模式的球周神经元或颗粒神经元。
神经干细胞增殖会随着年龄增长而下降。人们采取了各种方法来抵消这种与年龄相关的衰退。由于FOX 蛋白可调节神经干细胞稳态,人们已利用 FOX 蛋白抑制Wnt 信号来保护神经干细胞。
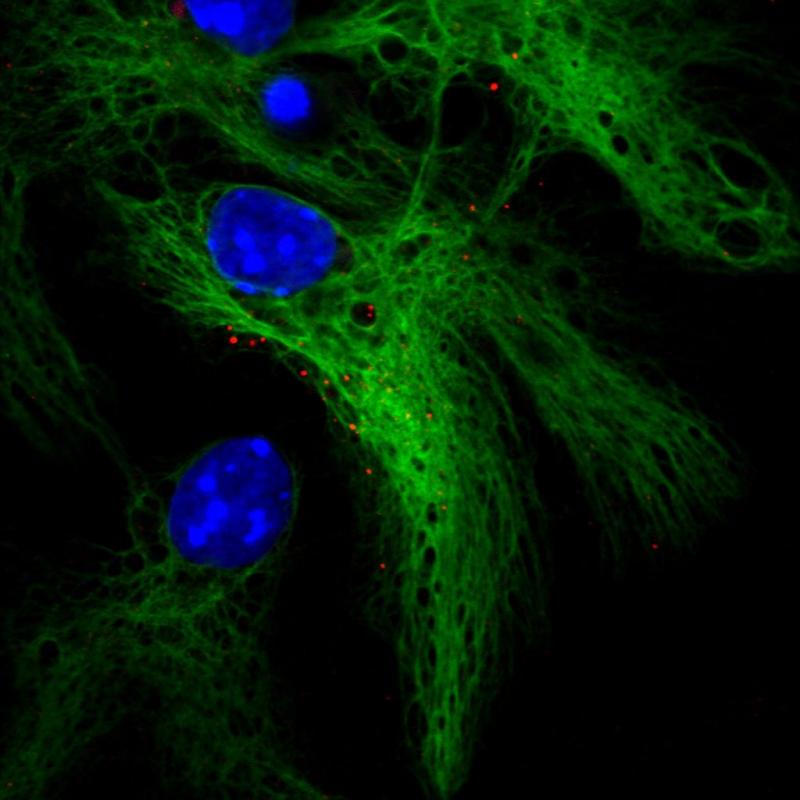
神经干细胞分化为星形胶质细胞(绿色),生长激素受体位点显示为红色
功能
表皮生长因子(EGF) 和成纤维细胞生长因子(FGF) 是体外促进神经祖细胞和干细胞生长的有丝分裂原,尽管神经祖细胞和干细胞群合成的其他因子也是最佳生长所必需的。据推测,成人大脑中的神经发生源自 NSC。成人大脑中 NSC 的起源和身份仍有待确定。
分化过程中
成人 NSC 最广泛接受的模型是放射状的胶质纤维酸性蛋白阳性细胞。静止干细胞是 B 型干细胞,由于脑内由血管、星形胶质细胞、小胶质细胞、室管膜细胞和细胞外基质组成的特定微环境提供的可再生组织,它们能够保持静止状态。这些微环境为干细胞提供营养、结构支持和保护,直到它们被外部刺激激活。一旦被激活,B 型细胞就会发育成 C 型细胞,即活跃的增殖中间细胞,然后分裂成由 A 型细胞组成的神经母细胞。未分化的神经母细胞形成链,迁移并发育成成熟的神经元。在嗅球中,它们成熟为 GABA 能颗粒神经元,而在海马中,它们成熟为齿状颗粒细胞。
表观遗传修饰是神经干细胞分化过程中基因表达的重要调控因子。关键的表观遗传修饰包括DNA 胞嘧啶甲基化形成5-甲基胞嘧啶和5-甲基胞嘧啶去甲基化。这些类型的修饰对于发育和成年哺乳动物大脑中的细胞命运决定至关重要。
DNA胞嘧啶甲基化由DNA甲基转移酶(DNMT)催化。甲基胞嘧啶去甲基化由进行氧化反应的TET酶(例如5-甲基胞嘧啶转化为5-羟甲基胞嘧啶)和DNA碱基切除修复(BER)途径的酶分几个不同的步骤催化。
患病期间
NSC 在发育过程中发挥着重要作用,在发育中的中枢神经系统中产生大量神经元、星形胶质细胞和少突胶质细胞。它们在成年动物中也发挥着重要作用,例如,除了为小鼠的嗅球提供神经元外,它们还参与成年小鼠的学习和海马可塑性。
值得注意的是,全球多个研究小组正在阐明 NSC 在疾病中的作用。动物模型和人类在中风、多发性硬化症和帕金森病期间的反应是当前研究的一部分。这项正在进行的研究的结果可能在未来应用于治疗人类神经系统疾病。
Sanjay Magavi 和Jeffrey Macklis进行的经典实验表明,神经干细胞可以迁移和替换死亡的神经元。 Magavi使用激光诱导皮质层损伤,证明 SVZ 神经祖细胞表达Doublecortin(神经母细胞迁移的关键分子),迁移到很远距离到受损区域并分化为表达NeuN标记的成熟神经元。此外,日本的 Masato Nakafuku 研究小组首次展示了海马干细胞在小鼠中风期间所起的作用。这些结果表明,神经干细胞可以因受伤而进入成人大脑。此外,2004 年,Evan Y. Snyder研究小组表明,神经干细胞以定向方式迁移到脑肿瘤。哈佛大学的医学博士Jaime Imitola和同事首次展示了神经干细胞对损伤作出反应的分子机制。他们发现,在小鼠中,损伤期间释放的趋化因子(如SDF-1a)负责人类和小鼠 NSC 定向迁移到损伤区域。从那时起,人们发现其他分子也参与了 NSC 对损伤的反应。所有这些结果都被其他研究人员广泛复制和扩展,加入了Richard L. Sidman在放射自显影中可视化发育过程中神经发生的经典工作,以及Joseph Altman在 20 世纪 60 年代对成人神经发生的研究,作为成人 NSC 活动和神经发生在体内平衡和损伤 期间的反应的证据。
寻找在损伤环境中起作用的其他机制以及它们如何影响急性和慢性疾病期间 NSC 的反应是当前深入研究的问题。
研究
中枢神经系统再生治疗
细胞死亡是急性中枢神经系统疾病以及神经退行性疾病的特征。由于中枢神经系统缺乏细胞替换和修复的再生能力,细胞损失会加剧。避免这种情况的一种方法是通过再生神经干细胞进行细胞替代疗法。神经干细胞可以在体外培养成神经球。这些神经球由神经干细胞和祖细胞 (NSPC) 以及 EGF 和 FGF 等生长因子组成。这些生长因子的撤出会激活神经元、星形胶质细胞或少突胶质细胞的分化,这些细胞可以移植到受伤部位的大脑内。这种治疗方法的益处已在帕金森病、亨廷顿病和多发性硬化症中得到检验。神经干细胞通过神经保护和免疫调节的内在特性来诱导神经修复。一些可能的移植途径包括脑内移植和异种移植。
对于神经退行性疾病,研究中出现的另一种移植疗法是神经干细胞的定向诱导。由于存活率低和分化不合理,直接移植 NCS 受到限制并面临挑战。为了克服这些限制,直接诱导 NCS 旨在在移植前操纵 NCS 的分化。目前,NSC 是从原代 CNS 组织、多能干细胞 (PSC) 的分化和体细胞的转分化中获得的。诱导的 NCS 可以从体细胞重新编程。因此,定向诱导从不同来源获取 NSC,并迫使它们分化为所需的神经谱系细胞。该技术治疗用途的一个例子是将腹侧中脑多巴胺能 (DAergenic) 神经元定向分化为不同的 PD 模型。目前,神经退行性疾病帕金森病 (PD) 的疗法包括多巴胺替代疗法 (DRT)。这种方法可以缓解 PD 症状,但随着病情的进展,缓解机制会受到非线性的影响。
NSPC 移植的另一种治疗方法是药物激活内源性 NSPC (eNSPC)。激活的 eNSPC 会产生神经营养因子,几种治疗方法可激活一条涉及 STAT3 在丝氨酸残基上的磷酸化以及随后 Hes3 表达升高的通路 ( STAT3-Ser/Hes3 信号传导轴),从而阻止神经系统疾病模型中的神经元死亡和疾病进展。
人类中枢神经系统3D体外模型的生成
人类中脑神经祖细胞 (hmNPC) 能够分化出多种神经细胞谱系,从而形成神经球和多种神经表型。hmNPC 可用于开发人类 CNS 的 3D体外模型。培养 hmNPC 的方法有两种:贴壁单层和神经球培养系统。神经球培养系统以前曾用于分离和扩增 CNS 干细胞,因为它能够在无血清培养基条件下以及在表皮生长因子 (EGF) 和成纤维细胞生长因子-2 (FGF2) 存在下聚集和增殖 hmNPC。最初,分离和扩增 hmNPC,然后进行 2D 分化,以产生单细胞悬浮液。这种单细胞悬浮液有助于实现均匀聚集体大小的同质 3D 结构。3D 聚集形成神经球,用于形成体外3D CNS 模型。
生物活性支架用于治疗创伤性脑损伤
创伤性脑损伤(TBI) 会使脑组织变形,导致坏死(原发性损伤),进而引发级联反应并引发继发性损伤,如兴奋性毒性、炎症、缺血和血脑屏障破坏。损伤会不断加剧,最终导致细胞凋亡。目前的治疗重点是通过稳定出血、降低颅内压和炎症以及抑制促凋亡级联反应来防止进一步损伤。为了修复 TBI 损伤,一种即将到来的治疗选择是使用来自胚胎脑室周围区域的 NSC 。干细胞可以在有利的三维低细胞毒性环境(水凝胶)中培养,当注入 TBI 患者体内时,这将增加 NSC 的存活率。注射到脑内后,观察到已引发的 NSC 迁移到受损组织并分化为分泌神经保护因子的少突胶质细胞或神经元细胞。
神经干细胞中的半乳糖凝集素-1
半乳糖凝集素-1在成人 NSC 中表达,并且已被证明在动物模型中对神经系统疾病的治疗中具有生理作用。使用 NSC 进行治疗有两种方法:(1) 刺激内在 NSC 促进增殖以替换受损组织,以及 (2) 将 NSC 移植到受损的脑区,以使 NSC 恢复组织。慢病毒载体用于感染人类 NSC (hNSC) 中的半乳糖凝集素-1,随后将其移植到受损组织中。与仅移植 hNSC 相比,hGal-1-hNSC 可以更好、更快地诱导受损组织的脑恢复,并减少运动和感觉缺陷。
化验
神经干细胞通常在体外使用一种称为神经球分析(或神经球培养系统)的方法进行研究,该方法首先由 Reynolds 和 Weiss 开发。神经球本质上是异质性的细胞实体,几乎完全由一小部分(1% 到 5%)缓慢分裂的神经干细胞及其后代(一群快速分裂的巢蛋白阳性祖细胞)形成。
这些祖细胞的总数决定了神经球的大小,因此,不同神经球群体中神经球大小的差异可能反映了其神经祖细胞增殖、存活和/或分化状态的改变。事实上,据报道,神经球培养中 β1整合素的缺失并不会显著影响 β1 整合素缺乏的干细胞形成新神经球的能力,但会影响神经球的大小:由于细胞死亡增加和增殖减少,β1 整合素缺乏的神经球整体上较小。
虽然神经球分析一直是分离、扩增甚至计数神经干细胞和祖细胞的首选方法,但最近的一些出版物强调了神经球培养系统作为确定神经干细胞频率的方法的一些局限性。 STEMCELL Technologies与 Reynolds 合作开发了一种基于胶原蛋白的检测方法,称为神经集落形成细胞 (NCFC) 检测,用于量化神经干细胞。重要的是,这种检测方法可以区分神经干细胞和祖细胞。
历史
神经发生发生在成年哺乳动物大脑某些区域的第一个证据来自 1965 年 Altman 和 Das 进行的 [3H]-胸苷标记研究,该研究表明幼鼠出生后海马神经发生。1989 年,Sally Temple描述了小鼠大脑脑室下区(SVZ)中的多能、自我更新的祖细胞和干细胞。1992 年,Brent A. Reynolds 和Samuel Weiss首次从成年小鼠脑组织的纹状体组织中分离出神经祖细胞和干细胞,包括 SVZ(神经发生区域之一)。同年, Constance Cepko和 Evan Y. Snyder团队首次从小鼠小脑中分离出多能细胞,并用致癌基因v-myc稳定转染它们。该分子是目前广泛用于将成人非干细胞重编程为多能干细胞的基因之一。从那时起,神经祖细胞和干细胞已从成人中枢神经系统的各个区域(包括非神经源性区域,如脊髓)和包括人类在内的各种物种中分离出来。
热门产品推荐
-
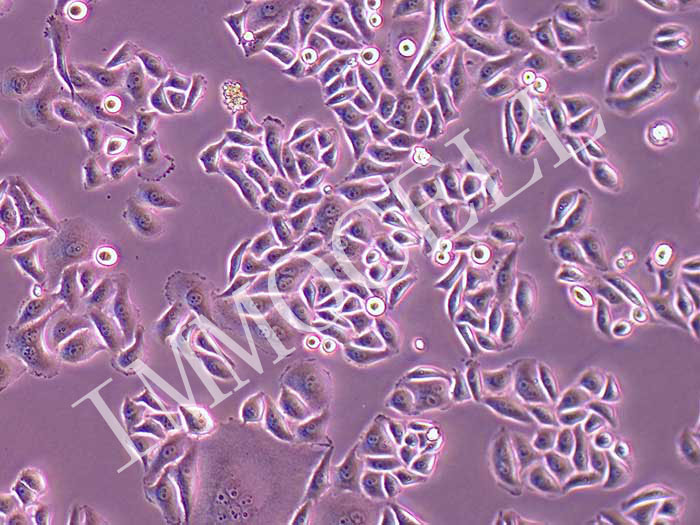
HELA人宫颈癌细胞(STR鉴定正确)
¥1200元
-
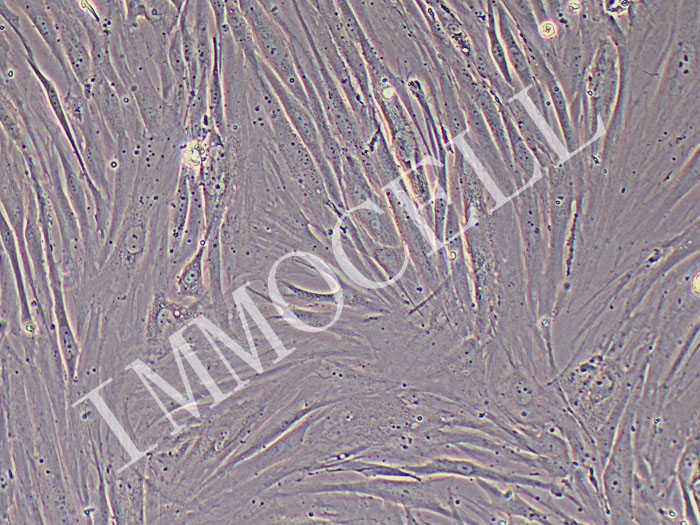
HSF人皮肤成纤维细胞(免疫荧光鉴定)
¥1800元
-
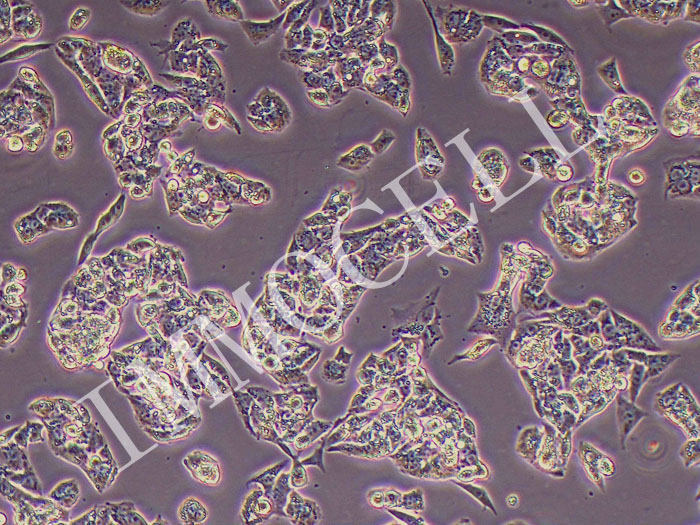
HepG2人肝癌细胞(STR鉴定正确)
¥1200元
-
A549人非小细胞肺癌细胞(STR鉴定正确)
¥1200元
-
H9C2大鼠心肌细胞
¥1200元
-
4T1小鼠乳腺癌细胞(STR鉴定正确)
¥1200元
大家都在看
-
人源肿瘤细胞系异体移植(cell derived xenograft, CDX),即将体外传代培养的肿瘤细胞接种至免疫缺陷小鼠,因其有明确的肿瘤生长动力学、易于遗传操作、成瘤率高、价格低廉等特点,并且能够产生一致和可重复的数据,···...
阅读详情 -
hiPSC人诱导多能干细胞培养教程:在培养hiPSC细胞前,需准备好hESC/iPSC完全培养基配制和Matrigel铺板,hiPSC人诱导多能干细胞复苏操作,1. 将水浴锅预热至37℃;并将Matrigel包被的6孔板,提前放置生物安全柜中约1小时恢复···...
阅读详情 -
H9人胚胎干细胞培养条件与方法:1. 将水浴锅预热至37℃,并将Matrigel包被的6孔板,提前放置生物安全柜中约1小时恢复至室温(15~30℃);2. 取4 mL hESC/iPSC完全培养基,按照1:4000比例加入1 μL的hESC/iPSC Supplement C,···...
阅读详情 -
H1人胚胎干细胞培养指南:在培养h1干细胞之前,首先要准备好hESC/iPSC完全培养基配制, 铺板,H1人胚胎干细胞复苏步骤:1.将水浴锅预热至37℃;并将Matrigel包被的6孔板,提前放置生物安全柜中约1小时恢复至室温(15~30℃);···...
阅读详情 -
4T1细胞培养方法:小鼠乳腺癌4T1细胞培养基 90%DMEM+10% FBS+PS,生长条件:气相:95%空气+5%二氧化碳;温度:37℃,4T1细胞形态特征为上皮细胞样,贴壁生长,如果4T1细胞密度达80%-90%,即可进行传代培养,传代方法:1:2至1:3···...
阅读详情 -
常用人肝癌细胞系有哪些及如何选择:目前较为常用的几株人肝癌细胞系SMMC-7721、Bel-7402、MHCC97、HepG2、Hep3B、Huh-7 and PLC/PRF/5,那么人肝癌细胞株如何选择呢?一方面你可以查找相关的文献,另一方面可以考虑选择···...
阅读详情
- 上一篇:星形胶质细胞(Astrocyte)
- 下一篇:小胶质细胞(Microglia)







