简介
破骨细胞(来自古希腊语ὀστέον(osteon)“骨头”和κλαστός(clastos)“破碎”)是一种分解骨组织的骨细胞。此功能对于脊椎骨骼的维护、修复和重塑至关重要。破骨细胞通过分泌酸和胶原酶在分子水平上分解和消化水合蛋白质和矿物质的复合物,这一过程称为骨吸收。该过程还有助于调节血钙水平。
破骨细胞位于正在发生吸收的骨表面。在这样的表面上,破骨细胞位于浅凹陷中,称为吸收湾(Howship 陷窝)。吸收湾是由破骨细胞对下层骨的侵蚀作用形成的。破骨细胞下部边界由于细胞膜深内褶而呈现手指状突起;这种边界称为褶皱边界。褶皱边界位于吸收湾内与骨表面接触。褶皱边界的周围被环状细胞质区包围,该区域没有细胞器但富含肌动蛋白丝。这个区域称为透明区或密封区。肌动蛋白丝使密封区周围的细胞膜牢固地锚定在 Howship 陷窝的骨壁上。这样,在皱褶边界和正在发生吸收的骨之间就形成了一个封闭的破骨细胞下隔室。破骨细胞分泌氢离子、胶原酶、组织蛋白酶 K和水解酶到这个隔室中。破骨细胞对骨基质的吸收包括两个步骤:(1) 无机成分(矿物质)的溶解;(2) 骨基质中有机成分的消化。破骨细胞将氢离子泵入破骨细胞下隔室,从而形成酸性微环境,增加骨矿物质的溶解度,导致骨矿物质释放并重新进入破骨细胞的细胞质中,并输送到附近的毛细血管。矿物质被去除后,胶原酶和明胶酶会分泌到破骨细胞下隔室中。这些酶消化和降解脱钙骨基质中的胶原蛋白和其他有机成分。降解产物被皱褶边界的破骨细胞吞噬。由于其吞噬特性,破骨细胞被认为是单核吞噬细胞系统(MPS) 的组成部分。破骨细胞的活性受激素和细胞因子控制。降钙素是甲状腺激素,可抑制破骨细胞活性。破骨细胞没有甲状旁腺激素 (PTH) 受体。然而,PTH 会刺激成骨细胞分泌一种称为破骨细胞刺激因子的细胞因子,这是一种有效的破骨细胞活性刺激剂。

单个破骨细胞
结构
破骨细胞是一种大型多核细胞,骨骼上的人类破骨细胞通常有四个细胞核,直径为150-200微米。当使用破骨细胞诱导细胞因子将巨噬细胞转化为破骨细胞时,会出现直径可达100微米的超大细胞。这些细胞可能有几十个细胞核,通常表达主要的破骨细胞蛋白,但由于非天然基质,它们与活骨中的细胞有显著差异。多核组装破骨细胞的大小使其能够将许多巨噬细胞的离子转运、蛋白质分泌和囊泡转运能力集中在骨骼的局部区域。
位置
在骨骼中,破骨细胞位于骨表面的凹坑中,这些凹坑被称为吸收凹陷或豪希普氏陷窝(Howship's lacunae)。破骨细胞的特征是细胞质具有均质的“泡沫状”外观。这种外观是由于囊泡和液泡浓度高所致。这些液泡包括充满酸性磷酸酶的溶酶体。这允许通过染色对酒石酸抗性酸性磷酸酶(TRAP) 和组织蛋白酶 K的高表达来表征破骨细胞。破骨细胞粗面内质网稀疏,高尔基复合体广泛。
在骨吸收活跃的部位,破骨细胞会形成一种特殊的细胞膜,即“褶皱边界”,与骨组织表面相对。这种大面积折叠或褶皱的边界通过显著增加细胞表面以分泌和吸收吸收隔室内容物,促进骨质去除,这是正在积极吸收骨质的破骨细胞的形态特征。
发展
自1873 年发现以来,关于其起源一直存在很大争议。三种理论占主导地位:从 1949 年到 1970 年,结缔组织起源理论很流行,该理论认为破骨细胞和成骨细胞属于同一谱系,成骨细胞融合形成破骨细胞。经过多年的争论,现在很清楚这些细胞是由巨噬细胞的自我融合发展而来的。 1980 年初,单核细胞吞噬系统被确认为破骨细胞的前体。破骨细胞的形成需要RANKL(核因子 κβ 配体的受体激活剂)和M-CSF(巨噬细胞集落刺激因子)的存在。这些膜结合蛋白由邻近的基质细胞和成骨细胞产生,因此需要这些细胞和破骨细胞前体直接接触M-CSF 通过破骨细胞上的受体 c-fms(集落刺激因子 1 受体)起作用,c-fms 是一种跨膜酪氨酸激酶受体,可导致酪氨酸激酶 Src 的次级信使激活。这两种分子都是破骨细胞生成所必需的,并广泛参与单核细胞/巨噬细胞衍生细胞的 分化。
RANKL 是肿瘤坏死家族 ( TNF )的成员,对破骨细胞生成至关重要。RANKL 基因敲除小鼠表现出骨质硬化症和牙齿萌出缺陷的表型,以及破骨细胞的缺失或不足。RANKL 通过RANK激活 NF-κβ(核因子-κβ)和 NFATc1(活化 T 细胞的核因子,细胞质,钙调磷酸酶依赖性 1) 。RANKL-RANK 相互作用发生后几乎立即刺激 NF-κβ 活化,并且不会上调。然而,NFATc1 刺激在结合发生后约 24-48 小时开始,并且其表达已被证明是 RANKL 依赖性的。
破骨细胞分化受到骨保护素(OPG) 的抑制,骨保护素由成骨细胞产生,并与 RANKL 结合,从而阻止与 RANK 的相互作用。破骨细胞来自造血谱系,而成骨细胞则来自间充质干细胞。
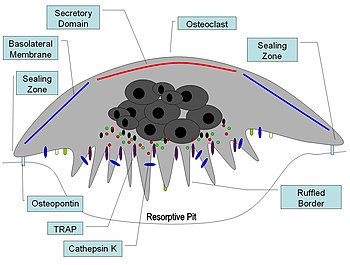
活化破骨细胞的横截面图
功能
一旦被激活,破骨细胞就会通过趋化作用移动到骨骼的微骨折区域。破骨细胞位于由下层骨骼消化而形成的称为 Howship 陷窝的小腔内。密封区是破骨细胞的质膜附着在下面骨骼上的地方。密封区由称为足小体的特殊粘附结构带包围。通过骨基质蛋白(如骨桥蛋白)中的特定氨基酸基序Arg-Gly-Asp,整合素受体(如 αvβ3)可促进破骨细胞附着在骨基质上。破骨细胞在碳酸酐酶的作用下通过褶皱边界释放氢离子(H 2 O + CO 2 → HCO 3 − + H +)进入吸收腔,酸化并帮助矿化骨基质溶解成Ca 2+、H 3 PO 4、H 2 CO 3、水和其他物质。据记载,碳酸酐酶功能障碍会导致某些形式的骨硬化症。氢离子通过质子泵(特别是独特的液泡 ATP 酶)逆着高浓度梯度泵送。这种酶是预防骨质疏松症的目标。此外,还会释放几种水解酶,例如组织蛋白酶和基质金属蛋白酶 (MMP) 组的成员,以消化基质的有机成分。这些酶由溶酶体释放到隔室中。在这些水解酶中,组织蛋白酶 K 是最重要的。
组织蛋白酶K和其他组织蛋白酶
组织蛋白酶 K是一种胶原酶分解木瓜蛋白酶样 半胱氨酸蛋白酶,主要在破骨细胞中表达,并分泌到吸收窝中。组织蛋白酶 K 是参与 I 型胶原蛋白和其他非胶原蛋白降解的主要蛋白酶。组织蛋白酶 K 基因突变与致密性骨质疏松症有关,这是一种遗传性骨质硬化疾病,其特征是缺乏功能性组织蛋白酶 K 表达。小鼠组织蛋白酶 K 的敲除研究导致骨质硬化表型,该表型部分由除组织蛋白酶 K 以外的蛋白酶表达增加和破骨细胞生成增强所补偿。
组织蛋白酶 K 在酸性条件下具有最佳酶活性。它作为分子量为 37kDa 的酶原合成,经自催化裂解活化后,转化为分子量约为 27kDa 的成熟活性形式。
当破骨细胞在骨吸收部位极化时,蛋白酶 K 从皱褶边界分泌到骨吸收窝中。蛋白酶 K 通过细胞间囊泡跨过皱褶边界,然后由功能性分泌域释放。在这些细胞间囊泡中,蛋白酶 K 与TRAP产生的活性氧一起进一步降解骨细胞外基质。
破骨细胞中还表达其他几种蛋白酶,包括蛋白酶 B、C、D、E、G和L 。这些半胱氨酸和天冬氨酸蛋白酶在骨骼中的功能一般未知,而且它们的表达水平比蛋白酶 K 低得多。
关于蛋白酶 L 基因敲除小鼠的研究结果不一,有报告称与野生型相比,纯合和杂合的蛋白酶 L 基因敲除小鼠的骨小梁减少,而另一份报告 未发现骨骼异常。
基质金属蛋白酶
基质金属蛋白酶( MMP) 包括 20 多种锌依赖性内切肽酶。基质金属蛋白酶 (MMP) 在破骨细胞生物学中的作用尚不明确,但在其他组织中,它们与肿瘤促进活动有关,例如激活生长因子,并且是肿瘤转移和血管生成所必需的。
MMP9与骨微环境有关。它由破骨细胞表达,已知是破骨细胞迁移所必需的,是一种强大的明胶酶。缺乏 MMP-9 的转基因小鼠在骨骼发育、骨内血管生成和骨折修复方面 会出现缺陷。
MMP-13被认为参与骨吸收和破骨细胞分化,因为敲除小鼠表现出破骨细胞数量减少、骨质硬化和骨吸收减少。
破骨细胞表达的MMP包括MMP-9、-10、-12和-14。除了MMP-9之外,人们对它们与破骨细胞的相关性知之甚少,然而,在密封区发现了高水平的MMP-14。
破骨细胞生理学
在 20 世纪 80 年代和 90 年代,人们详细研究了典型破骨细胞的生理学。随着褶皱边界的分离,人们直接在生化上详细研究了跨边界的离子运输。验证了能量依赖性酸转运,并纯化了假定的质子泵。随着破骨细胞的成功培养,人们发现它们被组织起来以支持大量质子的运输,从而酸化吸收区并溶解骨矿物质。这包括褶皱边界 Cl −通透性以控制膜电位和基底侧 Cl − /HCO 3 −交换以将细胞溶质 pH 值维持在生理可接受的范围内。
其离子分泌的有效性取决于破骨细胞在吸收隔室周围形成有效的密封。这种“密封区”的定位似乎是由破骨细胞表面表达的整合素介导的。密封区就位后,多核破骨细胞会自行重组。与吸收隔室相邻的高度内陷褶皱膜的形成可实现大规模分泌活动。此外,它还允许矿物质和降解的胶原蛋白从褶皱边界通过囊泡转胞吞作用转移到细胞的游离膜,并释放到细胞外隔室中。这种活动完成了骨吸收,矿物质成分和胶原蛋白片段都被释放到全身循环中。
规例
破骨细胞受多种激素调节,包括来自甲状旁腺的甲状旁腺激素(PTH)、来自甲状腺的降钙素和生长因子白细胞介素 6 (IL-6)。最后一种激素IL-6是骨质疏松症的因素之一。当破骨细胞的骨吸收活动与成骨细胞的骨形成活动之间失衡时,就会发生骨质疏松症。
破骨细胞活性也由成骨细胞产生的两种分子(即骨保护素和RANK 配体)相互作用介导。这些分子还调节破骨细胞的分化。
临床意义
某些疾病中可能会出现巨型破骨细胞,包括骨佩吉特病和双膦酸盐毒性。
在猫中,破牙细胞活性异常可导致猫破牙细胞吸收性病变,需要拔除受影响的牙齿。
破骨细胞在正畸牙齿移动和牙周受损牙齿的病理性移位中起主要作用。
热门产品推荐
-
HELA人宫颈癌细胞(STR鉴定正确)
¥1200元
-
HSF人皮肤成纤维细胞(免疫荧光鉴定)
¥1800元
-
Bel-7405人肝癌细胞(STR鉴定正确)
¥1200元
-
HepG2人肝癌细胞(STR鉴定正确)
¥1200元
-
A549人非小细胞肺癌细胞(STR鉴定正确)
¥1200元
-
H9C2大鼠心肌细胞
¥1200元
大家都在看
-
人源肿瘤细胞系异体移植(cell derived xenograft, CDX),即将体外传代培养的肿瘤细胞接种至免疫缺陷小鼠,因其有明确的肿瘤生长动力学、易于遗传操作、成瘤率高、价格低廉等特点,并且能够产生一致和可重复的数据,···...
阅读详情 -
hiPSC人诱导多能干细胞培养教程:在培养hiPSC细胞前,需准备好hESC/iPSC完全培养基配制和Matrigel铺板,hiPSC人诱导多能干细胞复苏操作,1. 将水浴锅预热至37℃;并将Matrigel包被的6孔板,提前放置生物安全柜中约1小时恢复···...
阅读详情 -
H9人胚胎干细胞培养条件与方法:1. 将水浴锅预热至37℃,并将Matrigel包被的6孔板,提前放置生物安全柜中约1小时恢复至室温(15~30℃);2. 取4 mL hESC/iPSC完全培养基,按照1:4000比例加入1 μL的hESC/iPSC Supplement C,···...
阅读详情 -
H1人胚胎干细胞培养指南:在培养h1干细胞之前,首先要准备好hESC/iPSC完全培养基配制, 铺板,H1人胚胎干细胞复苏步骤:1.将水浴锅预热至37℃;并将Matrigel包被的6孔板,提前放置生物安全柜中约1小时恢复至室温(15~30℃);···...
阅读详情 -
4T1细胞培养方法:小鼠乳腺癌4T1细胞培养基 90%DMEM+10% FBS+PS,生长条件:气相:95%空气+5%二氧化碳;温度:37℃,4T1细胞形态特征为上皮细胞样,贴壁生长,如果4T1细胞密度达80%-90%,即可进行传代培养,传代方法:1:2至1:3···...
阅读详情 -
常用人肝癌细胞系有哪些及如何选择:目前较为常用的几株人肝癌细胞系SMMC-7721、Bel-7402、MHCC97、HepG2、Hep3B、Huh-7 and PLC/PRF/5,那么人肝癌细胞株如何选择呢?一方面你可以查找相关的文献,另一方面可以考虑选择···...
阅读详情
- 上一篇:成骨细胞(Osteoblast)
- 下一篇:软骨细胞(Chondrocyte)







