写在前面
今天推荐的是由厦门大学生命科学学院和厦门大学第一附属医院妇产科发表在American Journal of Reproductive Immunology的一篇文章,通讯作者是Qiong-Hua Chen教授。
文章摘要
问题:来自子宫内膜异位症患者的原代在位子宫内膜细胞在研究中的应用由于寿命短、激素反应性去分化而受到限制。
研究方法:人类端粒酶逆转录酶 (hTERT) 诱导的永生化细胞 (iheESCs) 被慢病毒感染。通过 qRTPCR 检查 mRNA 水平,并通过蛋白质印迹定量蛋白质表达。 CCK-8 和 EdU 测定被指定用于评估增殖。通过transwell测定评估细胞的迁移和侵袭。克隆形成试验和裸鼠致瘤性试验用于评估集落形成和致瘤能力。
结果:与原代细胞相比,hTERT mRNA 和蛋白质在 iheESCs 中的表达显着高于原代细胞。 iheESCs 生长 42 代没有形态变化,这比原代细胞的 18 代长得多。原代细胞和iheESCs在生长、迁移率和染色体核型上没有明显差异。此外,上皮间质转化 (EMT) 标志物和雌激素/孕激素受体的表达保持不变。黄体酮和 cAMP 可以诱导 iheESCs 的蜕膜化。雌激素增加iheESCs的增殖和迁移能力,脂多糖(LPS)诱导IL-1β和IL-6促进炎症反应。与原代细胞一样,iheESCs 的集落形成能力低于 Ishikawa 细胞。此外,致瘤性测定表明,iheESCs 不能在 BALB/c 裸鼠中引发肿瘤形成。
结论:本研究建立并表征了 iheESCs,它保持了原代细胞的细胞生理学并且不具有致瘤能力。
因此,iheESCs 可用作体外细胞模型来研究子宫内膜异位症的发病机制。
研究背景
子宫内膜异位症的经典定义是存在子宫内位置之外的子宫内膜组织。子宫内膜异位症是一种雌激素依赖性炎症性疾病,可导致慢性盆腔疼痛、痛经、不规则子宫出血和不孕症。1,2 育龄女性盆腔子宫内膜异位症的发生率接近 10%。3 此外,子宫内膜异位症的复发率子宫内膜异位症达6%-67%,部分患者需要3次或以上手术4。因此,子宫内膜异位症严重影响患者的身心健康、人际关系和经济状况。
最广泛接受的子宫内膜异位症理论是子宫内膜组织的逆行月经通过通畅的输卵管进入腹膜腔。5,6 因此,腹膜腔内脱落的子宫内膜病变的存活能力对于建立可行的植入物至关重要。据报道,子宫内膜异位症的遗传特征在临床上得到证实,有病史的家族中子宫内膜异位症的发生率远高于未受影响的女性。 7,8 另一项研究发现,子宫内膜异位症患者的在位子宫内膜有几种与正常女性相比,基因组发生了改变。 9,10 此外,在位子宫内膜中发现异常的孕酮受体 (PR) 表达和孕激素抵抗,导致子宫内膜容受性受损。 11,12 这些发现表明,女性在位子宫内膜的基因组异常子宫内膜异位症可能导致子宫内膜异位症患者不孕并形成子宫内膜异位症病变。因此,关注在位子宫内膜异常的研究对于揭示子宫内膜异位症的发病机制至关重要。
原代子宫内膜细胞是研究子宫内膜异位症必不可少的工具,但原代细胞在细胞培养过程中往往会发生去分化,包括激素和细胞因子反应性的丧失、寿命短、迁移和侵袭的变化。因此,始终如一地供应具有稳定特性和长寿命的细胞对于研究应用非常重要。该研究建立并表征了在连续细胞培养中保持原始形态的永生化细胞,并且生长速率、流动性和上皮间充质蛋白、雌激素/孕激素受体表达保持不变。观察到iheESCs的雌激素刺激和炎症反应。综上所述,iheESCs 可作为体外细胞模型来研究在位子宫内膜的异常和子宫内膜异位症的发病机制。
研究内容
1.通过感染慢病毒建立iheESCs
为了产生具有 hTERT 过表达的永生化细胞,慢病毒被包装并用于感染在位子宫内膜基质细胞。如图 1A 所示,iheESCs 在第 5、15、25 和 35 段中稳定表达红色荧光蛋白 (RFP)。 hTERT 的 mRNA 和蛋白质在 iheESCs 中显着增加(图 1B,C)。与原代细胞相比,iheESCs 的形态没有变化(图 1D)。此外,iheESCs 可以传代到 42 代,比原代细胞长得多(图 1E)。
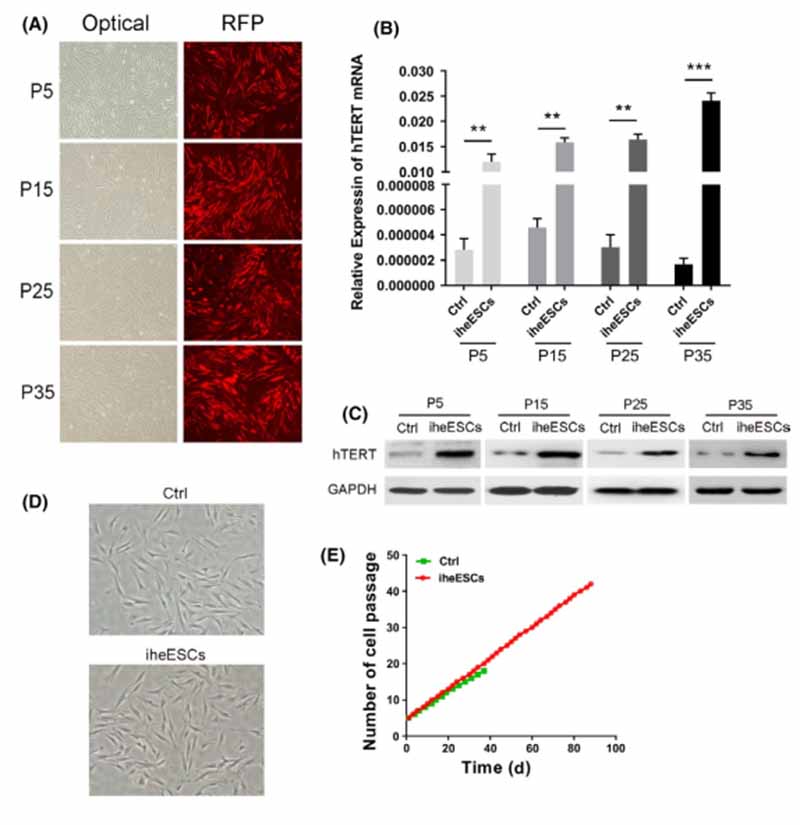
图1.通过感染慢病毒建立永生化的人类在位子宫内膜基质细胞 (iheESCs)。 (A) 原代基质细胞被带有红色荧光蛋白标签的慢病毒感染。 慢病毒感染后 hTERT mRNA (B) 和蛋白 (C) 的表达。 (D) 原代细胞和 iheESCs 的细胞形态。 (E) 通过连续培养处理的原代细胞和 iheESCs 的寿命。 数据代表平均值±SEM。 **P < .001, ***P < .0001。
2. iheESCs 的细胞生理学保持不变
为了进一步监测 iheESCs 的生理变化,检查了 iheESCs 的生长和流动性。原代细胞和 iheESCs 的生长曲线没有显着差异(图 2A)。 iheESCs 的迁移和侵袭都与原代细胞相似(图 2B,C)。此外,雌激素受体、孕激素受体和上皮间充质标记蛋白在原代细胞和 iheESCs 之间的表达是一致的(图 2D)。经过长期培养,iheESCs 中 ERs 和 PR 的 mRNA 表达与原代在位子宫内膜间质细胞相比保持不变,这与正常子宫内膜间质细胞不同(图 S1A-C)。为了区分上皮细胞和间充质细胞,使用免疫细胞化学分析细胞角蛋白 18 和波形蛋白的表达。 iheESCs 和初级保持较高水平的波形蛋白,而细胞角蛋白 18 的表达较低(图 2E)。为了进一步研究细胞是否被转化,进行核型分析以探索iheESCs的染色体情况如图 2F,iheESCs 维持 23 对染色质,表明 iheESCs 的核型保持正常。这些结果表明,iheESCs保持了原有的增殖和迁移能力,原代基质细胞的特性和雌孕激素受体的表达没有改变。
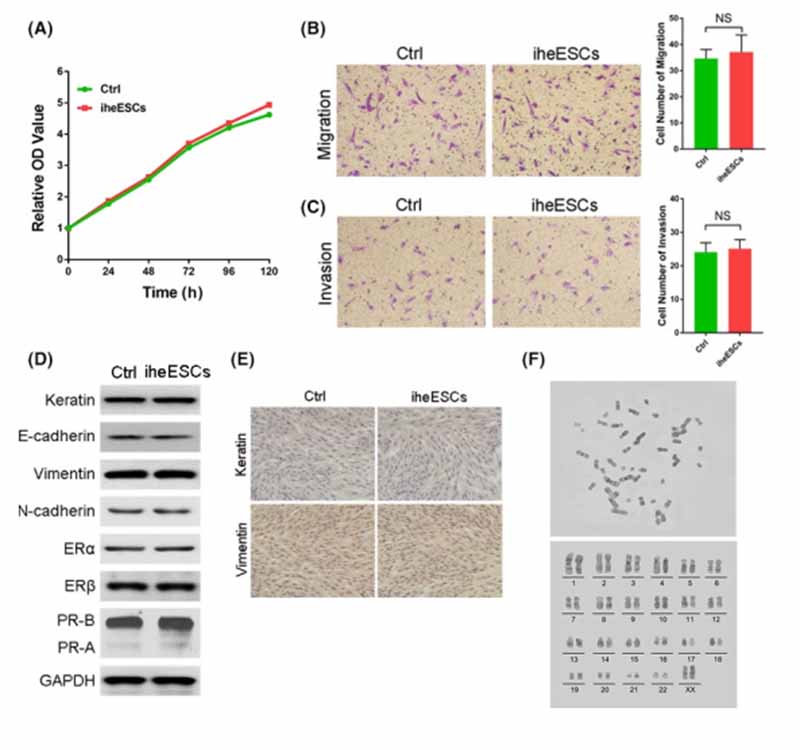
图2. iheESCs 的细胞生理学没有改变。 (A) 通过 CCK8 测定每 24 小时测定一次原代细胞和 iheESCs 的增殖。 (B) 通过
transwell 测定和量化分析评估的初级 ells 和 iheESCs 的迁移(右)。 (C) 原代细胞的侵袭测定和 iheESCs 量化分析 (右)。
(D) EMT 标志物、雌激素和孕激素受体在不同细胞中的表达。 (E) 通过免疫细胞化学评估上皮和间充质细胞的鉴定。 (F) iheESCs
的染色体核型分析和分选结果(下)。 数据代表平均值±SEM。 NS>0.05,*P < .01。
3. iheESCs 蜕膜化的诱导
为了进一步确认 iheESCs 的蜕膜能力,使用 1 μM 孕酮和 0.1 mM cAMP 刺激 iheESCs 以诱导蜕膜化。 iheESCs 的形态从纺锤形变为丰满的圆形(图 3A)。此外,IGFBP-1 和 PRL 的 mRNA 表达显着增加(图 3B,C)。因此,iheESCs 在黄体酮和 cAMP 的刺激下表现出足够的蜕膜表型。
4. 在 iheESCs 中检测到正常的雌激素应激和炎症反应证实雌激素对细胞增殖的调节作用
进行iheESCs、CCK8和EdU测定以检查增殖和细胞分裂。如图 4A 所示,iheESCs 的增殖随着雌激素的刺激而显着升高。在雌激素处理的细胞中,EdU 阳性细胞的百分比显着增加(图 4B)。此外, 雌激素处理的 iheESCs 更有能力迁移和入侵 (图 4C, D)。这些结果表明正常的雌激素应激反应在iheESCs中呈现稳定。为了检查iheESCs是否保持正常的炎症过程,采用qRT-PCR和Western印迹来测量LPS处理的iheESCs中IL-1β和IL-6的表达。 LPS 刺激增加了 IL-1β 和 IL-6 的 mRNA 和蛋白质表达(图 4E,F)。这些结果表明iheESCs保持正常的炎症反应。
5. iheESCs 不具备致瘤能力
为了进一步鉴定iheESCs的致瘤能力,采用集落形成试验和裸鼠致瘤性试验来解决iheESCs的致癌性。图 5A 的结果表明,原代细胞和 iheESCs 的集落形成相似且明显少于 Ishikawa 细胞。为了检查iheESCs是否恶化并获得致癌能力,将细胞注射到BALB/c裸鼠体内。原代细胞和 iheESCs 无法触发肿瘤形成,但阳性对照 Ishikawa 细胞成功形成肿瘤(图 5B)。因此,这些结果暗示 iheESC 不具备致瘤能力
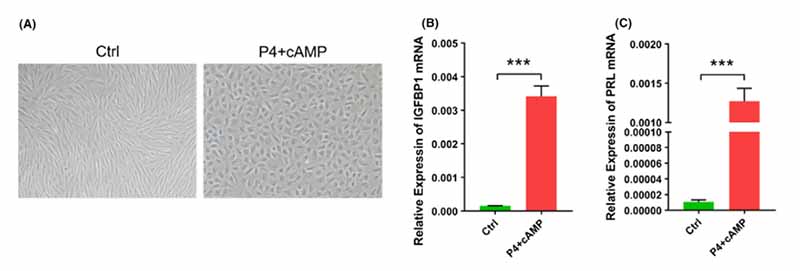
图3. iheESCs 蜕膜化的诱导。 (A) 用黄体酮和 cAMP 处理观察细胞形态。 (B) 蜕膜诱导后 IGFBP1 mRNA 的水平。 (C) 通过 qRT-PCR 分析的 PRL mRNA 的表达。 数据代表平均值±SEM。 ***P < .0001。
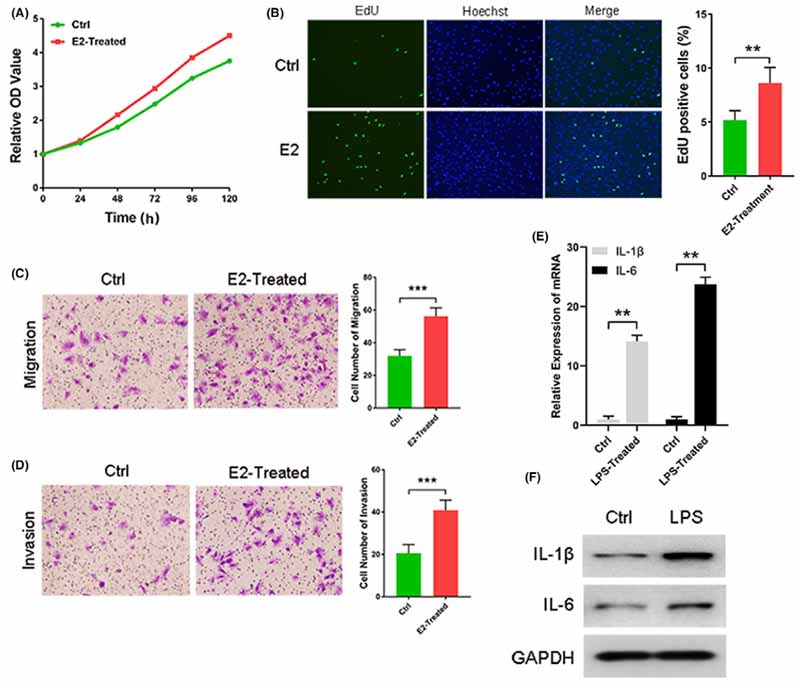
图4. 在 iheESCs 中发现了正常的雌激素应激和炎症反应。 (A) 在雌激素刺激下 iheESCs 的增殖。 (B) EdU 检测用于监测细胞分裂和量化分析(右)。 (C)通过transwell检测和定量分析(右)检测到雌激素处理后的细胞迁移能力。 (D) 评估暴露于雌激素的细胞侵袭和定量分析 (右)。 (E) 脂多糖 (LPS) 处理后 IL-1β 和 IL-6 mRNA 的相对表达。 (F) 蛋白质印迹法检测 IL-1β 和 IL-6 的蛋白质水平。 数据代表平均值±SEM。 **P < .001, ***P < .0001。
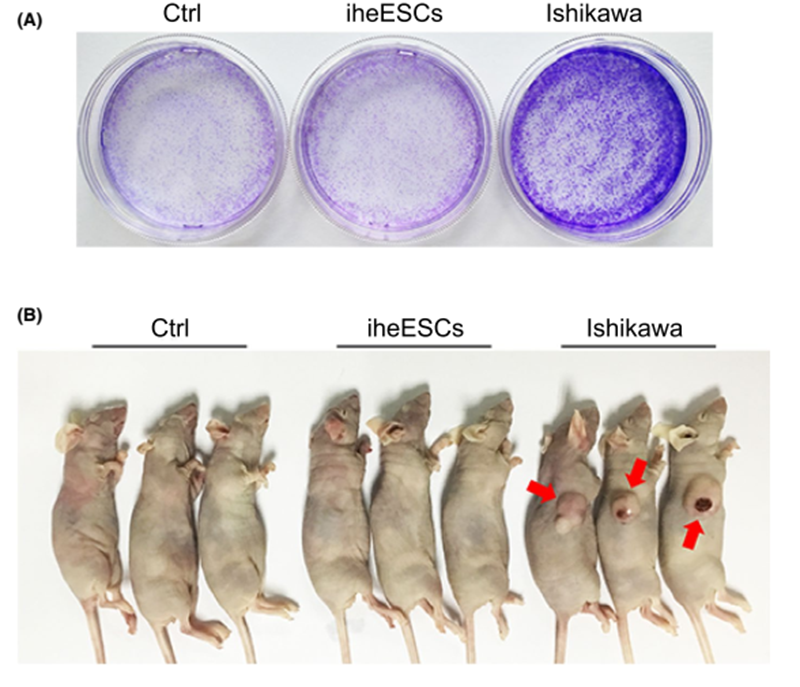
图5. iheESCs 不具备致瘤能力。 (A) 用于评估 iheESCs 致癌潜力的集落形成试验。 (B) 进行裸鼠致瘤性测定以评估 iheESCs 的致瘤能力
结论与讨论
在这项研究中,我们通过转染编码 hTERT 的慢病毒载体建立并表征了永生化的人类子宫内膜异位症在位基质细胞 (iheESCs)。 iheESCs 维持 hTERT 的高表达,在连续培养 42 代时保持原始形态。 iheESCs中雌激素/孕激素受体和EMT标志物的表达与原代细胞保持稳定一致。此外,iheESCs 保持正常生长和迁移和侵袭能力。 iheESCs 表现出由黄体酮和 cAMP 诱导的蜕膜化能力。在iheESCs中检测到正常的雌激素和炎症反应。此外,iheESCs 不具备致瘤能力。因此,iheESCs可以成为研究子宫内膜异常和子宫内膜异位症病理的理想工具细胞。
子宫内膜与正常和子宫内膜异位症女性之间存在许多巨大差异。与正常子宫内膜相比,在位子宫内膜的增殖增加。13-15 与正常子宫内膜相比,在位子宫内膜具有更高的迁移和侵袭能力。16,17 我们之前的研究发现,在位细胞中 EMT 水平显着提高。 18 因此,在位子宫内膜的高增殖、流动性和 EMT 可能与子宫内膜异位症的发病机制密切相关。通过转染 hTERT 建立的 iheESCs 保留了原始的生长速率、移动性和 EMT 水平。此外,iheESCs 在多代后仍保持间充质细胞的特征。这些结果表明iheESCs的细胞生理没有退化。因此,在子宫内膜异位症病理学研究中,使用iheESCs作为模型细胞替代原代细胞是可行的。
子宫内膜是动态的类固醇反应组织,它经历重复的生理周期,包括连续的增殖、分化、分解和修复,所有这些都与类固醇激素有关。 19 孕酮及其受体调节子宫内膜的蜕膜化。 20 iheESCs 的蜕膜化被诱导黄体酮和cAMP,这表明iheESCs的生理仍然受到黄体酮的深度调节。此外,该iheESCs中的蜕膜化表明iheESCs可用于子宫内膜容受性和胚胎植入的研究。另一方面,与炎症相互作用的雌激素在维持子宫内膜异位症中起着至关重要的作用。 21,22 我们之前的研究发现,雌激素通过 p38 上调细胞生长、流动性和 EMT 水平上述测定表明,iheESCs 的生长和迁移受雌激素的调节,因此 iheESCs 的细胞活性受雌激素的影响。此外,在 iheESCs 中检测到对 LPS 诱导的炎症的反应。因此,iheESCs可作为模型细胞系研究雌激素和炎症过程对子宫内膜异位症的影响和机制。
此外,其他小组通过使用各种方法使细胞永生化,克服了原代培养的局限性。 Yuhki 等人 24 建立了人类永生化子宫内膜基质细胞系 KC02-44D,它保持正常的蜕膜能力和炎症反应。 Holdsworth 等人 25 报道,永生化的人子宫内膜基质细胞系保持纯合子宫内膜异位症风险基因型和对激素(增殖和蜕膜变化)和炎症的不同反应。与保持原发性激素反应和炎症的 hTERT 永生化子宫内膜细胞相同,iheESCs 保持较长的细胞寿命,可达 40 代。进一步观察到 iheESCs 的流动性和 EMT 水平没有变化。此外,iheESCs 是不完全转化的细胞,没有恶性转化。因此,iheESCs在更广泛的应用领域提供更长的使用寿命,并保证应用安全。
建立永生化细胞的过程可能导致细胞退化,从而获得致瘤能力。然而,iheESCs 不具备致瘤能力并保持原代细胞的生长特性。因此,我们的研究结果表明,iheESCs保持稳定的特性和应激反应,可作为研究在位子宫内膜异常和子宫内膜异位症病理的理想细胞模型。
大家都在看
-
THP-1细胞培养指南及常见问题:THP-1细胞培养基:90% 1640+10% FBS+PS+ 0.05 mM 2-巯基乙醇(2-mercaptoethanol),如果THP-1细胞密度达80%-90%,即可进行传代培养,传代比例:1:2至1:3,THP-1细胞有密度依赖性,低密度时细胞···...
阅读详情 -
vero细胞培养条件及方法:vero细胞培养基MEM+10%FBS+1%PS,如果vero细胞密度达80%-90%,即可进行传代培养,传代比例:1:2至1:3,每周 2-3次,vero细胞生长条件:气相:95%空气+5%二氧化碳;温度:37℃...
阅读详情 -
MCF-7细胞培养条件及注意事项:MCF-7细胞培养基89%DMEM+10%FBS+1%PS+0.01mg/ml insulin,培养条件气相:95%空气+5%二氧化碳;温度:37℃,培养箱湿度70%-80%,MCF-7细胞贴壁较慢,处理后最好48h后再观察,MCF-7细胞培养需要加···...
阅读详情 -
RAW 264.7细胞培养传代及冻存处理:需要准备培养基:DMEM+10%FBS+PS、培养皿、无血清冻存液,RAW 264.7细胞传代步骤如下,a、将含有1mLRAW 264.7细胞悬液的冻存管在 37℃水浴中迅速摇晃解冻,加4 mL培养基混合均匀;b、在1···...
阅读详情 -
MDCK细胞培养方法及应用:MDCK细胞培养基:MEM(ATCC改良)+10%FBS+PS,生长条件;气相:95%空气+5%二氧化碳;温度:37℃,MDCK细胞被广泛用作远曲小管或集合管的模型,还可用于代谢研究和Pg级药物与药物相互作用研究以及观察流···...
阅读详情 -
乳腺癌研究常用细胞系及其优化实验方案:绝大多数乳腺癌都是起始于乳腺导管细胞,只有10%的乳腺癌起始于乳腺小叶细胞,另有一些罕见起源的乳腺癌种类,由于乳腺附近存在淋巴结和淋巴腺,这也是乳腺癌易于扩散转移的原因之···...
阅读详情
相关问答
-
细胞名称:A7r5细胞系(A7R5大鼠胸大动脉平滑肌细胞)客户问题:细胞中黑色的是什么?原因分析:1.棉球纤维、凋亡细胞片、血清蛋白,或一些无血清培养基添加因子后的因子析出物,属于正常现象;2.如果是传代后细胞堆···...
阅读详情 -
细胞增殖速度怎么变得这么慢了?细胞发生病变,出现细胞变圆、从培养瓶壁脱落又是什么情况?要疯了,培养细胞怎么就这么难呢~实验过程中存在的“幽灵”,即使是经验丰富的老研究员也不得不面对,没错,它就是支原体感···...
阅读详情 -
胎牛血清和小牛血清的差别在哪里? 胎牛血清和小牛血清的差别在哪里? 胎牛血清(FBS) :从八月龄胎牛心脏穿刺取血。适用于专业的研究和试验,包括干细胞研究、免疫分析和抗体生产。 新生牛血青/小牛血清(NBCS) :从自出···...
阅读详情 -
适合细胞长期保存的温度是多少? 适合细胞长期保存的温度是多少? 细胞长期保存温度是-130°C或更低。液氮罐中气态层温度在-140°C至-180°C之间细胞可保存在气态层或浸入液氮中,如果可以最好保存在气态层,因为这样···...
阅读详情 -
如何在细胞铺板时避免“边缘效应”? 如何在细胞铺板时避免“边缘效应”? 以下这三点一定要注意!细胞实验铺板时,为避免“边缘效应”,以应用96孔板的中间60孔为最佳,一般四周的一圈边缘孔不养细胞,只做空白或阴性···...
阅读详情 -
如何收获需要冻存的细胞?最佳是什么时候?如何收获需要冻存的细胞?最佳是什么时候?用来冻存的细胞一般选择在细胞约铺满90%的时候,这时细胞生长状态好,细胞数量也多并且在收获细胞前24小时换一次培养液。收获用来冻···...
阅读详情