背景简介
二十世纪七十年代,Friedenstein首次从骨髓中分离出一种多能基质细胞,呈梭形,可以进行体外克隆和多向分化,被称为CFU-Fs(colony-forming unit fibro-blasts)。随后,这种骨髓来源的基质细胞被进一步发现是间叶组织细胞谱系的共同前体细胞,因其具有干细胞的部分特性,而被命名为骨髓间充质干细胞(BMSCs)。
BMSCs来源方便,易于分离、培养、扩增和纯化,多次传代扩增后仍具有干细胞特性,免疫原性低。但是不同的分离培养方法使得BMSCs在体外扩增时的纯度、活性、表型和分化潜能差异很大,导致基础研究结论各异和临床试验效果不一。因此,深入认识BMSCs不同分离方法和培养条件的优缺点,并根据实验目的做出相应选择,是进行BMSCs实验研究的关键环节。
目前用于分离BMSCs的方法主要有五种,分别是贴壁筛选法、骨组织消化法、密度梯度离心法、流式细胞仪分离法和磁珠分选法。
贴壁筛选法是利用细胞贴壁时间及贴壁牢固性的不同,逐步将非贴壁细胞和其它杂质细胞去除的一种简单易行的方法,常用于干细胞的培养中,因此用于分离BMSCs最为广泛。
利用BMSCs贴壁生长特性,更换培养液逐步去除漂浮生长的造血系统细胞即可获得较纯化的BMSCs;而且骨髓中的造血干细胞能分泌生长因子和促贴壁物质,可促进BMSCs贴壁生长,贴壁筛选法也常被称为直接培养法或者全骨髓法。
对初次培养者来说,贴壁法分离BMSCs操作简单易掌握,不易发生污染,是一个较好的分离方法。
准备工作
1. 6孔板,移液器,巴式管,1ml注射器,细胞培养箱,超净工作台,低速离心机,4℃冰箱,-80℃冰箱,细胞冻存管,T25细胞培养瓶,眼科剪,尖头镊
2. 分离BMSC所需的试剂有逸漠生物间充质干细胞基础培养基,逸漠生物胎牛血清,DMSO,双抗,逸漠生物PBS , 逸漠生物0.25%胰酶,逸漠生物无血清细胞冻存液,
分离过程
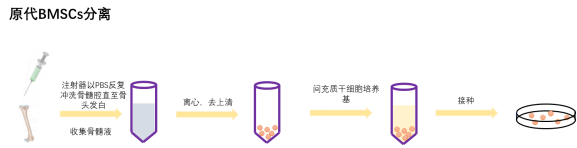
1. 以颈椎脱臼法处死SPF级出生1-3D(最大也可至4周龄)C57BL/6J小鼠或者SD/Wistar大鼠,用75%乙醇浸泡。
2. 随后在鼠的腿的位置剪开外皮和内皮,无菌状态下取出双侧股骨和胫骨,浸泡于无菌含双抗PBS溶液中。剔除股骨和胫骨周围的肌肉、结缔组织,用含双抗的PBS溶液清洗三遍。
3. 用眼科剪剪去股骨和胫骨的两端,暴露骨髓腔。
4. 用注射器以PBS反复冲洗骨髓腔直至骨头发白。
5. 收集骨髓液,过40μM细胞筛。
6. 收集过滤骨髓液,离心,后加入培养基接种于培养基皿中置于37℃,5% CO2,饱和湿度的细胞培养箱中培养。
7. 24-48h后去悬浮,接下来的每3天换液一次,直到需要传代。
注意事项
1. 全程无菌操作,鼠要提前酒精浸泡防止污染,仔细剥离去除血管和筋膜组织。
2. 剪开皮肤的剪刀需与取材的剪刀相区分,避免污染。
大鼠/小鼠骨髓间充质干细胞鉴定
1. 形态学观察
原代培养后,传代2-3次,BMSCs呈现单层,梭状或多枝状的细胞形态,其直径在25-30um,待细胞达到汇合时,它们形态上呈纺锤形,类似于成纤维细胞,贴壁较牢固。
2. 标记物检测
一般的标准为CD29、CD44、CD73、CD105为阳性(>90%);CD34、CD45、CD11b为阴性(<5%)。
3. 诱导分化实验
在特定的诱导条件下,脂肪间充质干细胞可以分化为成骨细胞、软骨细胞、脂肪细胞、神经细胞、上皮细胞、心肌细胞等多种细胞。
热门产品推荐
-
HELA人宫颈癌细胞(STR鉴定正确)
¥1200元
-
HSF人皮肤成纤维细胞(免疫荧光鉴定)
¥1800元
-
Bel-7405人肝癌细胞(STR鉴定正确)
¥1200元
-

Hep G2人肝癌细胞(STR鉴定正确)
¥1200元
-
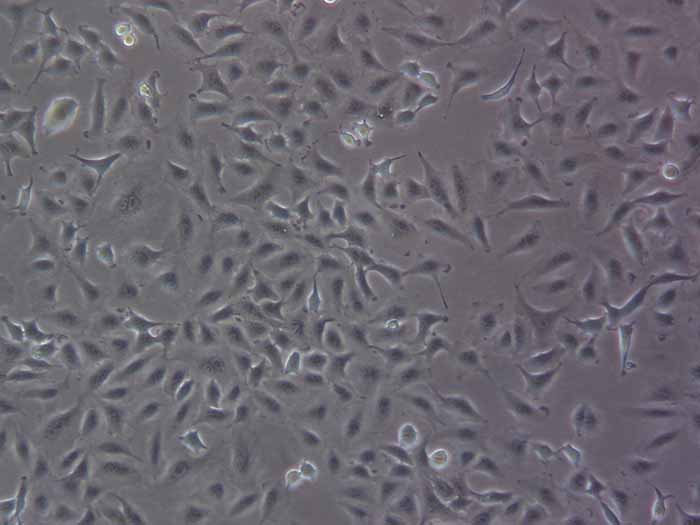
A549人非小细胞肺癌细胞(STR鉴定正确)
¥1200元
-
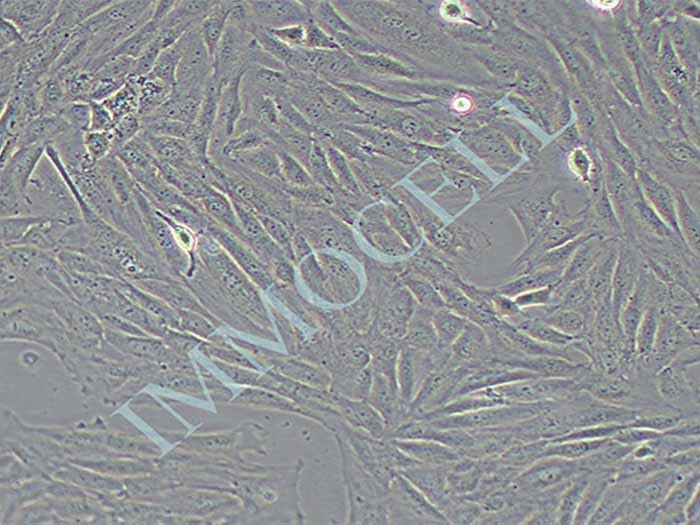
H9C2大鼠心肌细胞(种属鉴定正确)
¥1200元
大家都在看
-
hiPSC人诱导多能干细胞培养教程:在培养hiPSC细胞前,需准备好hESC/iPSC完全培养基配制和Matrigel铺板,hiPSC人诱导多能干细胞复苏操作,1. 将水浴锅预热至37℃;并将Matrigel包被的6孔板,提前放置生物安全柜中约1小时恢复···...
阅读详情 -
H9人胚胎干细胞培养条件与方法:1. 将水浴锅预热至37℃,并将Matrigel包被的6孔板,提前放置生物安全柜中约1小时恢复至室温(15~30℃);2. 取4 mL hESC/iPSC完全培养基,按照1:4000比例加入1 μL的hESC/iPSC Supplement C,···...
阅读详情 -
H1人胚胎干细胞培养指南:在培养h1干细胞之前,首先要准备好hESC/iPSC完全培养基配制, 铺板,H1人胚胎干细胞复苏步骤:1.将水浴锅预热至37℃;并将Matrigel包被的6孔板,提前放置生物安全柜中约1小时恢复至室温(15~30℃);···...
阅读详情 -
4T1细胞培养方法:小鼠乳腺癌4T1细胞培养基 90%DMEM+10% FBS+PS,生长条件:气相:95%空气+5%二氧化碳;温度:37℃,4T1细胞形态特征为上皮细胞样,贴壁生长,如果4T1细胞密度达80%-90%,即可进行传代培养,传代方法:1:2至1:3···...
阅读详情 -
常用人肝癌细胞系有哪些及如何选择:目前较为常用的几株人肝癌细胞系SMMC-7721、Bel-7402、MHCC97、HepG2、Hep3B、Huh-7 and PLC/PRF/5,那么人肝癌细胞株如何选择呢?一方面你可以查找相关的文献,另一方面可以考虑选择···...
阅读详情 -
HL-60细胞生长慢解决方法及如何养好:当HL-60细胞传代后生长速度慢且状态不佳时,可竖着培养直到培养基变黄,待细胞密度起来后,状态会有所好转,同时,若HL-60细胞状态很差,可采用半换液的方式:以T25瓶子为例,瓶子里有5m···...
阅读详情







