产品介绍
由研发团队精心研制的间充质干细胞成骨诱导分化试剂盒,包含适合间充质干细胞生长的基础培养基、优级胎牛血清及诱导细胞分化所需的添加物。
本产品适用于间充质干细胞的成骨诱导分化。大量细胞培养数据验证,本产品可稳定、高效诱导上述细胞分化为成骨细胞。
注意:本产品仅提供给进一步科研使用,不可用于临床治疗等其他用途。
成骨分化套装
| 成骨分化套装成分 | 货号 | 体积 |
Mesenchymal Stem Cells Osteogenic Differentiation Medium MSC-ODM | IMC-011-M | 180mL |
| 优级胎牛血清 | IMC-101-10 | 20mL |
Supplement For Mesenchymal Stem Cells Osteogenic Differentiation A 间充质干细胞成骨诱导分化添加物A | IMC-011-A | 1mL |
| Alizarin Red S 茜素红 | IMC-901 | 10mL |
| Gelatin明胶 | IMC-902 | 10mL |
质量控制
通过细菌、真菌、支原体、内毒素检测。
通过渗透压、pH检测。
通过产品性能检测
处理原则
1.严格的无菌环境。务必保证实验室整体和操作区域的清洁。
2.规范的操作方式。请按照产品说明书描述的方式操作,严格控制变量,做好对照实验。
3.各成分需按照保存条件妥善存放,并尽快使用。
4.若短期内无法用完整套培养基,应按套装内各成分体积比例分批配制并分装保存。
产品稳定性及保存条件
1.套装内所有成分均需避光保存。
2.套装内基础培养基需置于4℃冰箱保存,保质期为1年;其他成分需置于-20℃保存,保质期为2年。
3.配制后的完全培养基,需放置4℃保存,保质期为1个月;若能保证培养条件稳定,容器密封性能良好,避免冷热交替,则保质期可适当延长,但不得超过45天。
4.所有产品请于保质期内使用;过期的成分可能严重影响培养效果
完全培养基的配制
所需材料
1.间充质干细胞成骨诱导分化试剂盒
2.清洁、无菌、质量稳定的一次性耗材(移液管、移液器吸头、离心管等)
3.洁净的封口膜
4.铝箔纸等避光材料
操作步骤
1.配制前至少6h,将套装中的优级胎牛血清(以下简称血清)放置于4℃冰箱内完全融化。
注意:融化后的血清中可能出现絮状物,其主要成分为析出的血纤蛋白,这不会影响产品使用效果。若不是对细胞培养体系的纯净度要求极高,我们不建议过滤或离心去除絮状物。
2.配制前至少30min,将套装中间充质干细胞成骨诱导分化添加物(以下简称添加物)放置于4℃冰箱内,直至完全融化。
3.上下颠倒或轻弹试剂管以混匀试剂。
4.用75%医用酒精仔细擦拭所有成分外包装。在超净台内打开包装。
5.将血清、添加物全部加入细胞基础培养基(以下简称基础培养基)中。
6.取少量基础培养基,洗涤各瓶、管,尽可能将所有成分全部加入基础培养基中。
7.拧紧基础培养基瓶盖,轻柔并充分摇匀。
8.用封口膜密封瓶口,用铝箔纸包裹瓶身,并标注名称、配制日期等信息。
特别提醒
1.若短期内无法用完全部培养基,我们建议分批配制;请按照套装内各成分比例,配制所需量;但剩余的成分必须严格按照各自的保存条件妥善保存,并且不可多次冻融。
2.间充质干细胞成骨诱导分化试剂盒内的所有成分都严格控制无菌,一般情况下我们不建议再次除菌。若配制过程有污染风险,可将完全培养基过滤除菌。
3.配制完成的成骨诱导分化培养基,请分装为小份,避免整瓶培养基反复温浴和冷藏交替
诱导分化操作流程
所需材料
1.间充质干细胞成骨诱导分化试剂盒
2.0.1%明胶溶液
3.Phosphate-BufferedSaline(1×PBS)
操作步骤
注意
1)本操作规程以六孔板为例,请根据实际情况选用合适的培养容器;
2)为减少诱导过程细胞漂起、不贴壁,建议使用明胶包被培养容器;
3)诱导培养基在使用前均需预热至37℃。
1.加1mL0.1%明胶到六孔板中,摇匀,使其能均匀覆盖各孔底面。
2.将铺有0.1%明胶的六孔板放置在超净台或CO2培养箱至少30min。
3.30min后吸去明胶即可用于接种细胞,或等待六孔板晾干再接种。
4.将待诱导的间充质干细胞按照2×104cells/cm2的细胞密度接种于六孔板中,每孔加入2mL普通完全培养基。
5.细胞置于37℃、5%CO2、饱和湿度的CO2培养箱中培养。
6.当细胞融合度达到70%时,小心地将孔内完全培养基吸走,向六孔板中加入2mL间充质干细胞成骨诱导分化培养基。
7.每隔3天换用新鲜的间充质干细胞成骨诱导分化培养基。
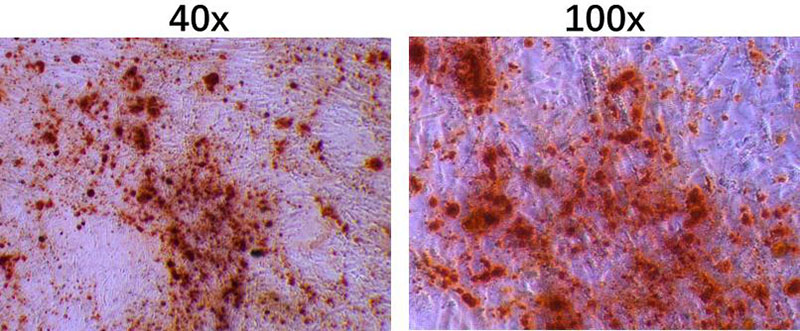
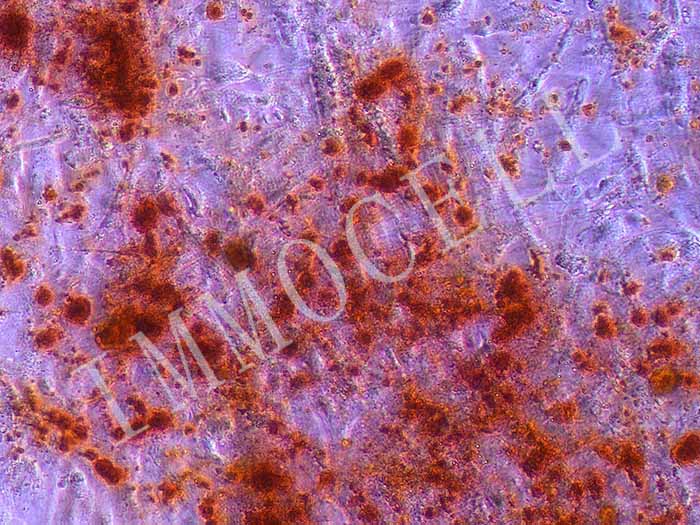
8.诱导2~4周后,视细胞的形态变化及生长情况,用茜素红进行染色。
注意:为防止成骨细胞脱落、钙结节损失,建议成骨过程中出现明显钙结节之后,每三天半量换液一次
茜素红染色分析
所需材料
1.Phosphate-BufferedSaline(1×PBS)
2.4%多聚甲醛溶液或10%福尔马林溶液
3.茜素红染色液
操作步骤
注意:
1)为防止钙结节脱落,所有操作尽可能轻缓;
2)茜素红使用前请恢复至室温;如果染色效果较差,可适当延长染色时间;
3)请确认出现钙结节后再进行染色。
1.成骨诱导分化结束后,吸去六孔板中的成骨诱导分化完全培养基,用1×PBS轻柔洗涤2~3次。
2.每孔加入2mL4%多聚甲醛溶液(或10%福尔马林),室温固定30min。
3.吸去固定液,用1×PBS轻柔洗涤2~3次,确保将固定液清洗彻底。
4.每孔加入2mL茜素红工作液,室温染色5~10min。
5.吸去茜素红染色液,用1×PBS轻柔洗涤2~3次,充分洗去多余染色液。
6.每孔加入2mL1×PBS,将培养板置于显微镜下观察成骨染色效果。
7.染色后的六孔板用封口膜封装后,置于4℃可保存2周
染色效果图