文章摘要
胸腺上皮细胞(TEC)作为胸腺内三维支架中的关键细胞,通过粘连性内切和各种细胞因子的释放,在T细胞前体的归巢,迁移和分化中起着关键作用。在这项研究中,分离小鼠TEC的原代培养物,并用TEC-specific抗体CK5和CK8进行鉴定。这些TEC通过猿猴病毒(SV)40大T抗原的逆转录病毒转导而永生化。然后,我们比较了TEC和永生化TEC(iTEC)的功能。通过倒置显微镜摄影和传代后结晶紫测定法观察了TECs和iTEC的细胞形态和增殖能力。然后进行软琼脂测定以观察其克隆形成能力。采用IF和qPCR检测IL-7、Lptin、Pax-9、Sema3A等上皮细胞相关因子的表达水平。将TEC与人急性单核细胞白血病细胞(THP-1)共培养,并用flow细胞术和CFSE标记观察TECs对促进THP-1增殖的影响。测量衰老相关的b-半乳糖酶-dase测定以检测细胞的抗衰老能力。通过碘化丙啶(PI)染色分析细胞周期分布,通过膜联蛋白V-PI染色检测d紫杉醇(PTX)诱导的细胞凋亡,以评价细胞的抗凋亡能力。纵观本文,我们发现永生化的TEC仍然保留了原代TEC的特征,如形态、功能和上皮特征;然而,iTEC在增殖和抗衰老方面具有更强的能力。研究表明,iTEC被SV40大T抗原成功永生化,iTEC的生物学特征和功能与原始TEC相似。这种永生化细胞可用作胸腺功能研究的应急细胞模型,用iTEC替代原代TEC。
研究背景
作为T细胞发育的主要器官,胸腺在产生具有自身耐受适应性免疫功能的成熟T细胞中起着关键作用。T细胞能够识别自身主要组织相容性复合体(MHC)分子,并在胸腺中进行负选择后能够区分自身抗原和非自身抗原。
胸腺由两个功能区室组成,即髓质和皮层。TEC是两个隔间中的关键单元。TECs和发育中的胸腺细胞之间的相互作用是复杂的三维上皮细胞网络发育的关键过程,也是胸腺细胞在两个胸腺区室正常发育中的分化和成熟的关键过程。在此期间,TECs分泌的因子起着关键作用。对胸腺生物学认识的最新进展表明,TECs的复杂三维网络以及胸腺细胞和上皮细胞之间的相互作用对于维持正常的胸腺功能至关重要。人类T细胞发育的研究需要强大的模型系统来概括胸腺生成的整个跨度。因此,大量研究致力于构建三维细胞模型或人工胸腺类器官(ATO)系统,用于研究胸腺中人类T细胞从造血干细胞和祖细胞(HSPC)中的选择和成熟。通过成熟的T细胞。
然而,由于缺乏公认的TEC细胞系,这些系统显示出很高的实验变异性。培养的原代TECs的体外复制寿命有限,限制了在细胞水平上对胸腺功能的研究。缺乏稳定和公认的胸腺细胞模型严重限制了在细胞水平上对胸腺细胞和TECs之间相互作用的研究。因此,延伸一条永生化TECs(iTECs)线是非常有意义的。
SV40T是一种病毒蛋白,可促进端粒酶的活化并介导生长抑制剂的失活[6]。多项研究表明,将SV40T病毒转染到细胞中可以使不同类型的细胞类型永生化,例如犬附睾细胞系[7]、人肝星状细胞系[8]和猪结肠上皮细胞系[9]。本研究的目的是利用SV40T病毒建立iTEC模型,并观察细胞特性和功能的变化[10]。它有助于为研究人类T细胞发育和基于干细胞的体外工程T细胞疗法方法提供稳定的工具。
研究内容
1.iTECs表达上皮细胞特异性标志物CK5和CK8
通过逆转录病毒将异源基因SV40T转移到TECs中。用4mg/mL潮霉素筛选后,体外培养阳性细胞。观察到的细胞状态良好,形态稳定。PCR结果显示,iTECs组在500bp左右有一条亮带,与预期的目标片段位置476bp和TECs中未显示的目标带一致(图1A)。结果表明,外源基因SV40T已成功整合到TECs基因组中。TECs和iTECs的免疫荧光染色显示它们均表达上皮细胞特异性标志物CK5和CK8。TECs和iTECs的典型细胞质和核染色结果如图2A所示。表明分离的细胞确实是胸腺上皮细胞,成功地永生化,并保留了原代TECs的上皮特性。
2.iTECs表现出高增殖和克隆形成活性
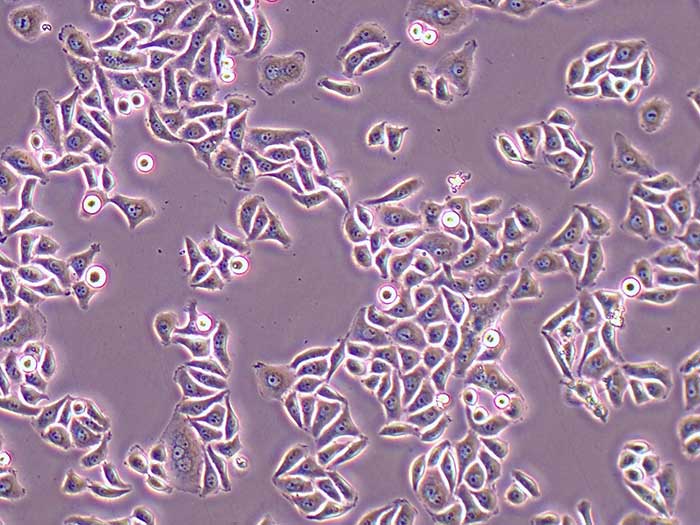
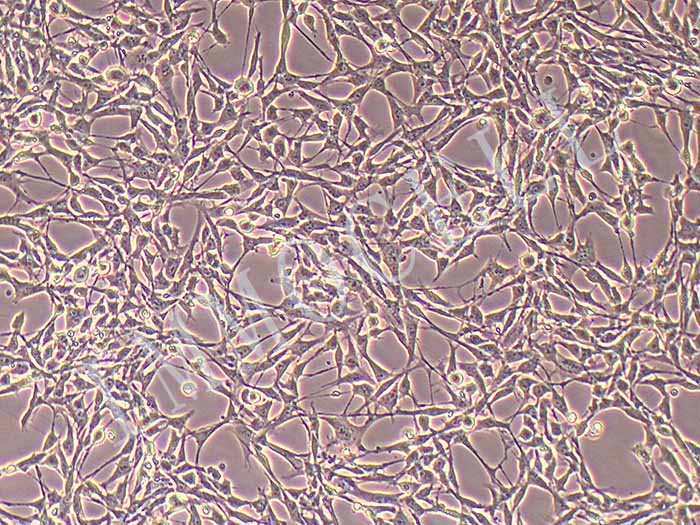
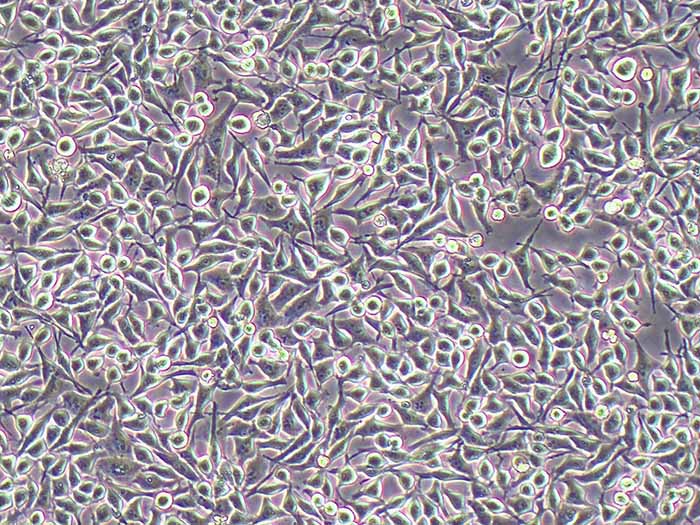
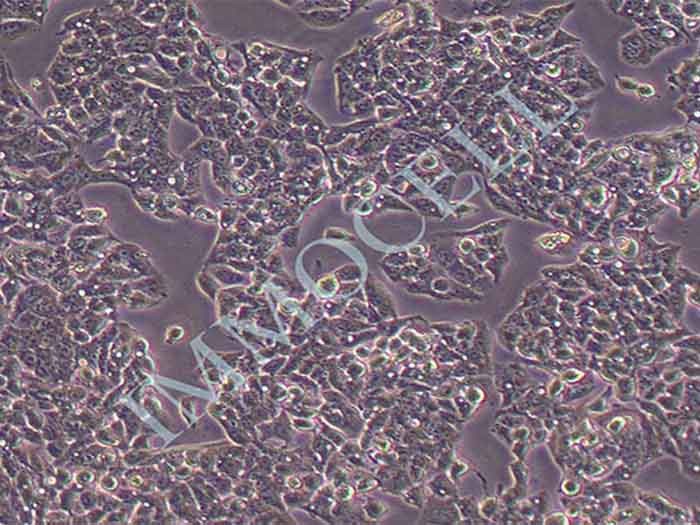
结晶紫实验表明TECs和iTECs组的细胞数量在传代后d1时是相同的。传代到d4后,iTEC组的细胞明显增多,这意味着iTECs的增殖率明显高于TECs(图1C)。此外,两种细胞的细胞形态也不同:TECs呈规则的椭圆形,细胞触角短,生长集中致密,而iTECs呈明显的梭形,细胞分散且独立生长(图1)。1D)。结果类似于Toouli等人的结果[17]。软琼脂上的集落形成结果表明TECs和iTECs都可以形成细胞集落。菌落直径
iTEC中200mm占iTEC组总菌落的59.52±14.14%,而TEC组仅占11.67±3.50%(图1B)。细胞周期结果显示,TECs中G0/G1、G2/M和S细胞的比例分别为36.83±1.96%、18.43±5.81%和45.44±5.63%,而各时期iTECs的比例为27.99±2.52%和16.11±6.34%、54.40±8.0%(图3A)。结果表明,永生化后TECs的形态发生了变化。iTECs的细胞增殖和克隆形成能力高于TECs。
3.iTECs更能耐受DNA损伤和老化
为了评估TECs和iTECs对DNA损伤的反应是否不同,每个细胞系都暴露于DNA嵌入剂PTX。ANNIXIN-V-FITC/PI双染结果显示,TECs-Control组、TECs-PTX组、iTECs-Control组和iTECs-PTX组细胞凋亡率分别为16.70±3.70%、22.34±4.21%、9.92±2.79%和16.50±3.65%(图3B)。值表示为平均值±标准差,n=3。结果表明iTECs对PTX诱导的DNA损伤更耐受。细胞衰老是机体抑制肿瘤的一种机制,也是衰老的原因之一。老化细胞表现出与衰老相关的b-半乳糖苷酶(SA-b-半乳糖苷酶)染色呈绿色阳性,并显示扁平细胞形态[18]。结果表明,当TECs和iTECs都在第3位时
传代后,TECs和iTECs中阳性细胞(衰老细胞)的比例分别为5.49%和5.81%(图3Ca和3Cc)。当TECs传到第6代时,阳性细胞率为45.04%。相比之下,iTECs在第12代时,阳性细胞数明显减少,细胞形态呈扁平状(图3Cb和3Cd)。结果表明,与TECs相比,iTECs具有更快的分裂增殖能力和更强的抗衰老能力。
4.iTECs表达TEC标记和相关因子
我们全面检测了TECs增殖、分化和激活过程中关键因子的表达水平,包括TNF-a、IL-1b、IL-7、Sema-3A、Leptin、ACTH、FGFR2IIIb、Foxn1及其下游基因Pax9.半定量RT-PCR(qPCR)结果显示TECs和iTECs分泌的上述细胞因子的表达水平相似,差异无统计学意义(图2B)。结果证实,永生化后胸腺上皮细胞的上皮功能没有明显变化。
5.iTECs和TECs对THP-1增殖表现出相似的促进作用
CFSE染色的THP-1细胞与TECs或iTECs共培养48h,流式细胞仪检测THP-1细胞增殖情况。结果显示,对照组、TECs组和iTECs组THP-1在亲本组中的比例分别为66.09±3.55%、54.51±7.18%和53.25±7.39%。与Control组相比,TEC组和iTEC组母体细胞比例降低,差异有统计学意义(p<0.01);然而,TEC组和iTEC组之间的差异没有统计学意义(图4A)。
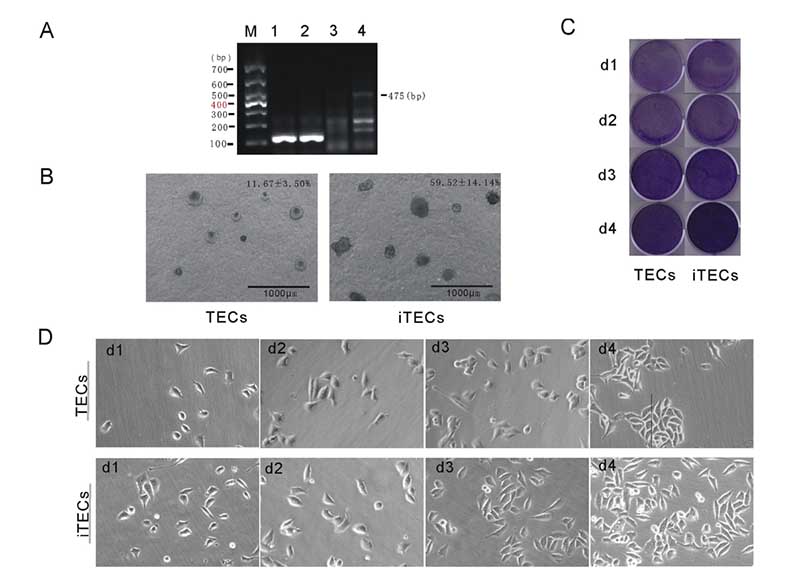
图1.(A)PCRAssay的凝胶电泳检测TECs和iTECs中的SV40T。M:600bp梯形图,TECs(1)和iTECs(2)的GAPDH,3:TECs(3)和iTECs(4)的SV40T。(B)TECs和iTECs在软琼脂中的菌落生长能力。(C)结晶紫染色法测定细胞活力和增殖。细胞在所描述的指定时间点用结晶紫染色。(D)相同通道的原代和永生化小鼠胸腺上皮细胞的形态学。(有关此图例中颜色参考的解释,请读者参考本文的网络版本。)
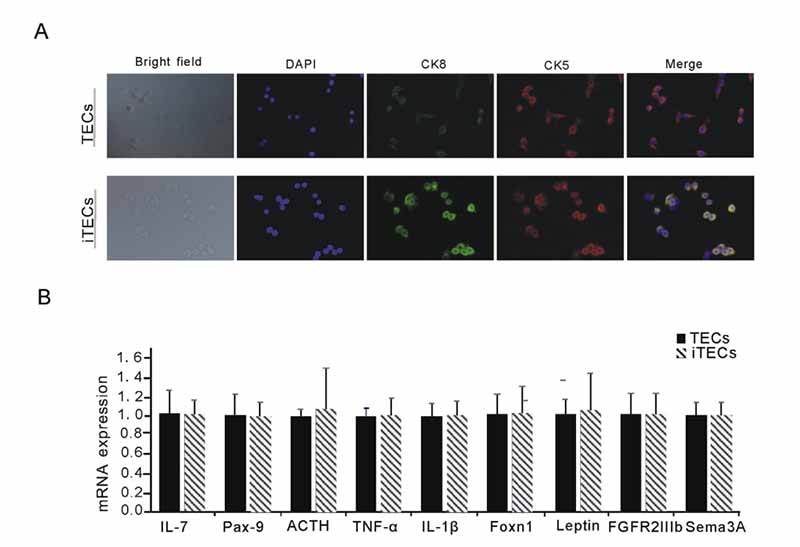
图2.(A)iTECs表达与TECs相同的上皮细胞特异性标志物。DAPI(蓝色)、CK5(红色)和CK8(绿色)以及TECsGroup和iTECsGroup的合并图像;照片是在放大400倍的显微镜下拍摄的。(B)条形图表示TECs和iTECs中TNF-a、IL-1b、IL-7、Sema3A、Leptin、ACTH、FGFR2IIIb、Foxn1和Pax9mRNAs的相对表达(平均值±S.E.M.)。数据来自三个独立的实验。(有关此图例中颜色参考的解释,请读者参考本文的网络版本。)
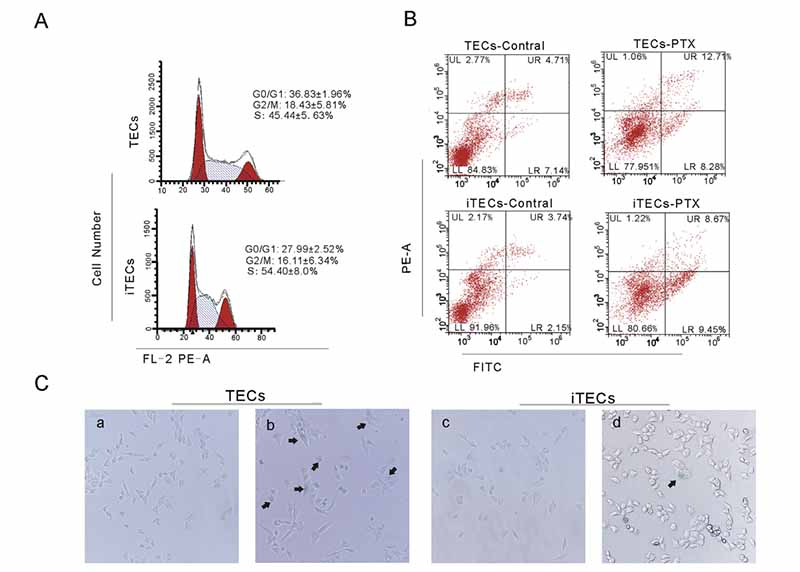
图3.(A)TECs和iTECs的细胞周期率。(B)PTX对TECs和iTECs凋亡率的影响。(C)在第3代(a)和第6代(b)的TECs组和第3代(c)和第12代(d)的iTECs组中进行衰老相关的b-gal染色。黑色箭头指向蓝色染色的细胞。
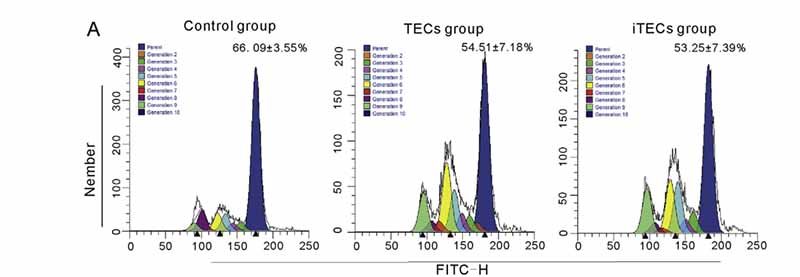
图4.CSFE染色用于测试TECs和iTECs对THP-1细胞增殖的影响。数据代表母细胞率(%)和平均值±SE,n=3。
结论与讨论
关于胸腺功能,TECs是研究的主要细胞类型之一,因此在免疫学基础研究中引起了极大的关注。可逆的SV40T介导的永生化策略赋予TECs无限的文化寿命,对TECs的应用具有重要意义。作为建立永生化细胞系最常用的方法,由SV40编码的大T抗原在感染从有限组织来源分离的允许细胞导致恶性转化中起重要作用。在我们的研究中,SV40LT-SSR69质粒被用来感染原代TECs,因此,永生化的TECs附着在培养皿底部,可以连续传递。iTECs生长更快并保持较高的增殖率(图1C)。事实上,iTEC到现在已经传了超过45代,并且增殖良好。iTECs的细胞形态等基本特征与TECs相似,iTECs具有上皮细胞的生长特征。IF结果显示iTECs仍表达CK5和CK8,从而保留了TECs的上皮功能。
细胞周期分析、细胞凋亡分析和软琼脂集落形成分析结果也表明,iTECs的增殖和存活率优于TECs。TECsS期细胞为45.44±5.63%,低于iTECs54.40±8.0%,TECsG0/G1期细胞百分比显着高于iTECs。PTX诱导的正常TECs的凋亡率也高于iTECs。TECs和iTECs都可以在软琼脂培养基中生长,但无论克隆的数量或大小如何,iTECs都具有更显着的克隆形成能力。永生化可以延长TEC在培养条件下的细胞寿命。我们检测到了生物标志物“衰老相关的β-半乳糖苷酶”(SA-b-gal),
这可以方便地在体外识别单个衰老细胞。β-半乳糖苷酶是一种稳定的酶,广泛存在于体外和体内不同来源的衰老细胞中[19]。衰老和永生化细胞群中的半乳糖苷酶活性表明,在TECs中SA-b-gal染色细胞(细胞质被染成绿色)的阳性百分比较高。
TECs通过分泌不同种类的细胞因子来调节T淋巴细胞的正向和负向选择。TNF-α是一种多效性细胞因子,在胸腺中组成型表达[20]。白细胞介素(IL)-7是T淋巴细胞发育和体内平衡所必需的细胞因子[21],而白细胞介素1β(IL-1b)主要来源于免疫细胞[2,22]。轴突排斥因子Sema3A参与胸腺中的许多细胞过程,包括胸腺细胞的粘附和迁移[23-25]。激素因子(如瘦素,至少在一定程度上通过激素对T细胞的直接作用来调节适应性免疫[26,27],促肾上腺皮质激素(ACTH)在调节胸腺增大中起核心作用,对活化的体外人类B细胞[33,34])。Forkhead-box转录因子n1(Foxn1)及其下游配对盒基因9(Pax9)调节TEC分化并驱动未成熟上皮细胞分化为功能性cTECs和mTECs[28-30]。成纤维细胞生长因子受体2IIIb(FGFR2IIIb)信号传导对胸腺上皮增殖至关重要[31,32]。在这项研究中,它们在TEC和iTECs中都以相同的水平表达。
总之,永生化TECs的生物学特性和功能与原始TECs的生物学特性和功能没有显着差异,我们的研究表明,永生化可以延长TECs的体外培养时间。iMHCs仍具有正常TECs的分泌功能,可促进单核细胞的增殖。本研究为研究胸腺和胸腺细胞发育和体外功能提供了另一种细胞模型。
大家都在看
-
THP-1细胞培养指南及常见问题:THP-1细胞培养基:90% 1640+10% FBS+PS+ 0.05 mM 2-巯基乙醇(2-mercaptoethanol),如果THP-1细胞密度达80%-90%,即可进行传代培养,传代比例:1:2至1:3,THP-1细胞有密度依赖性,低密度时细胞···...
阅读详情 -
vero细胞培养条件及方法:vero细胞培养基MEM+10%FBS+1%PS,如果vero细胞密度达80%-90%,即可进行传代培养,传代比例:1:2至1:3,每周 2-3次,vero细胞生长条件:气相:95%空气+5%二氧化碳;温度:37℃...
阅读详情 -
RAW 264.7细胞培养传代及冻存处理:需要准备培养基:DMEM+10%FBS+PS、培养皿、无血清冻存液,RAW 264.7细胞传代步骤如下,a、将含有1mLRAW 264.7细胞悬液的冻存管在 37℃水浴中迅速摇晃解冻,加4 mL培养基混合均匀;b、在1···...
阅读详情 -
MCF-7细胞培养条件及注意事项:MCF-7细胞培养基89%DMEM+10%FBS+1%PS+0.01mg/ml insulin,培养条件气相:95%空气+5%二氧化碳;温度:37℃,培养箱湿度70%-80%,MCF-7细胞贴壁较慢,处理后最好48h后再观察,MCF-7细胞培养需要加···...
阅读详情 -
MDCK细胞培养方法及应用:MDCK细胞培养基:MEM(ATCC改良)+10%FBS+PS,生长条件;气相:95%空气+5%二氧化碳;温度:37℃,MDCK细胞被广泛用作远曲小管或集合管的模型,还可用于代谢研究和Pg级药物与药物相互作用研究以及观察流···...
阅读详情 -
乳腺癌研究常用细胞系及其优化实验方案:绝大多数乳腺癌都是起始于乳腺导管细胞,只有10%的乳腺癌起始于乳腺小叶细胞,另有一些罕见起源的乳腺癌种类,由于乳腺附近存在淋巴结和淋巴腺,这也是乳腺癌易于扩散转移的原因之···...
阅读详情
相关问答
-
细胞增殖速度怎么变得这么慢了?细胞发生病变,出现细胞变圆、从培养瓶壁脱落又是什么情况?要疯了,培养细胞怎么就这么难呢~实验过程中存在的“幽灵”,即使是经验丰富的老研究员也不得不面对,没错,它就是支原体感···...
阅读详情 -
胎牛血清和小牛血清的差别在哪里? 胎牛血清和小牛血清的差别在哪里? 胎牛血清(FBS) :从八月龄胎牛心脏穿刺取血。适用于专业的研究和试验,包括干细胞研究、免疫分析和抗体生产。 新生牛血青/小牛血清(NBCS) :从自出···...
阅读详情 -
适合细胞长期保存的温度是多少? 适合细胞长期保存的温度是多少? 细胞长期保存温度是-130°C或更低。液氮罐中气态层温度在-140°C至-180°C之间细胞可保存在气态层或浸入液氮中,如果可以最好保存在气态层,因为这样···...
阅读详情 -
如何在细胞铺板时避免“边缘效应”? 如何在细胞铺板时避免“边缘效应”? 以下这三点一定要注意!细胞实验铺板时,为避免“边缘效应”,以应用96孔板的中间60孔为最佳,一般四周的一圈边缘孔不养细胞,只做空白或阴性···...
阅读详情 -
如何收获需要冻存的细胞?最佳是什么时候?如何收获需要冻存的细胞?最佳是什么时候?用来冻存的细胞一般选择在细胞约铺满90%的时候,这时细胞生长状态好,细胞数量也多并且在收获细胞前24小时换一次培养液。收获用来冻···...
阅读详情 -
培养基中谷氨酰胺究竟有什么作用?培养基中谷氨酰胺究竟有什么作用?几乎所有的细胞对谷氨酰胺有较高的要求,细胞需要谷氨酰胺合成蛋白质,在缺少谷氨酰胺时,细胞生长不良而死亡。所以各种培养液中都含有较大量的谷···...
阅读详情